Nessa nota de aplicação, a ITC e DSC permitiram a caracterização de ligações proteína-excipiente como uma das muitas interações possíveis em uma formulação de solução de proteína complexa.
Biopharmaceutical Technologies, GlaxoSmithKline R&D, 709 Swedeland Rd,
King of Prussia, PA 19406 (EUA)
O desenvolvimento de produtos terapêuticos baseados em proteínas é uma tarefa desafiadora à instabilidade de proteína inerente, que pode se manifestar como uma instabilidade física (desdobramento, agregação, adsorção) e degradação química (oxidação, desaminação, clivagem). Essas instabilidades podem resultar na diminuição da atividade da proteína ou mesmo em geração de espécies potencialmente imunogênicas. Uma abordagem à estabilização da proteína é alterar as propriedades do solvente em contato com ela, o que pode ser realizado por meio da seleção cuidadosa do sistema de tampão, ajuste do pH e adição de excipientes/aditivos (p.ex., criando uma formulação ideal).
Um fator importante na estabilização baseada em solvente de fármacos de proteína é a escolha dos excipientes adequados; igualmente importante é a otimização de concentrações de excipiente que prolongam a vida útil ao mesmo tempo em que garantem maior segurança ao paciente. Assim, uma parte crítica do desenvolvimento de formulação de fármaco de proteína é a seleção de excipientes que sejam adequadamente solúveis e não tóxicos, manter a integridade estrutural da proteína, viabilizar uma vida útil aceitável ao produto e preservar a atividade biológica do produto. Esses excipientes podem incluir aminoácidos, sais, metais, surfactantes, açúcares e polióis e polímeros. Eles podem servir como estabilizadores, agentes tensoativos, agentes antimicrobianos ou antioxidantes. Normalmente, seus efeitos estabilizantes são específicos à proteína e dependentes da concentração.
Juntamente com a seleção do excipiente, devem ser coletadas não somente informações sobre concentração ideal de excipientes, mas também sobre as interações entre vários componentes da formulação. A otimização da seleção e concentração de cada excipiente pode ser uma tarefa exaustiva que envolve a seleção de formulação e estudos de estabilidades abrangentes. Embora a literatura tenha fornecido os princípios gerais de estabilização na última década (1), ainda não há um entendimento completo sobre os mecanismos pelos quais os excipientes podem melhorar a estabilidade de uma proteína durante o armazenamento. O conhecimento dos mecanismos de interações de excipientes com proteínas eliminaria uma abordagem de seleção estritamente empírica e permitiria um projeto e uma otimização racionais da formulação de proteínas, diminuindo os requisitos de tempo e material para o desenvolvimento de produtos de proteína. Além disso, as informações sobre a força e o tipo de interações proteína-excipiente ajudariam a prever o comportamento do fármaco de proteína in vivo.
As técnicas de análise biofísica se mostraram extremamente úteis na seleção de excipientes para desenvolvimento de formulação. Em particular, a calorimetria é um dos métodos mais eficientes para avaliar a estabilidade e interações da proteína, já que permite uma caracterização termodinâmica completa do sistema, desde que todos os eventos sejam reversíveis. As investigações calorimétricas para explorar as interações entre proteínas e excipientes têm sido cada vez mais utilizadas para o planejamento e otimização de formulações biofarmacêuticas. A calorimetria é baseada no princípio da determinação da energética e estequiometria de interações macromoleculares por meio da medição de trocas de calor resultantes de processos de associação, dissociação e/ou desdobramento. A ITC é utilizada principalmente para determinar os parâmetros de ligação termodinâmica, como afinidade de ligação e constantes de dissociação, assim como estequiometria, entalpia, entropia e energia livre de ligação Gibbs sob condições isotérmicas. Ela também pode ser usada para determinar as mudanças da capacidade térmica na ligação, executando experimentos por meio de uma gama de temperaturas. Os dados da DSC fornecem os parâmetros termodinâmicos de desdobramento de proteína, inclusive a temperatura de desdobramento do ponto intermediário, entalpia, entropia, energia livre Gibbs e alterações de capacidade térmica no desdobramento.
Esses parâmetros termodinâmicos são comumente utilizados para comparar a estabilidade da proteína em diferentes formulações, ou para determinar os efeitos estabilizantes ou desestabilizantes relativos de certos excipientes.
Essa nota de aplicação apresenta um exemplo de como a calorimetria auxiliou no desenvolvimento da formulação do ProX, fornecendo perspectivas sobre as interações entre excipiente e proteína. O polissorbato-80 e fenol são examinados aqui como aditivos potenciais para o tampão da formulação para ProX. O polissorbato-80 é um surfactante normalmente utilizado para evitar a adsorção e agregação não específicas de proteínas, e foi demonstrada previamente sua interação com proteínas (2, 3). Ele protege a proteína contra agregação induzida pela superfície por meio da ligação a regiões hidrofóbicas expostas na superfície da molécula da proteína (3). Os níveis mais utilizados de polissorbato-80 são 0,002 a 0,1% (w/v). O fenol é utilizado como um agente antimicrobiano para formulações que serão dosadas mais de uma vez do mesmo recipiente. O fenol é tóxico e, portanto, deverá ser reduzida a concentração utilizada no tampão da formulação. Os níveis mais utilizados são 0,3 a 0,5% (v/v).
Os experimentos foram realizados com um MicroCalTM VP-Capillary DSC. Foram depositados quatrocentos (400) µL de cada amostra e tampão compatível em uma placa de 96 poços. As amostras foram analisadas de 25 ºC a 100 ºC a uma taxa de varredura de 60 ºC por hora, com um tempo de equilíbrio de 15 minutos antes de cada varredura. Os dados foram analisados com software Origin versão 7 para DSC, seguido de subtração do tampão e correção de concentração da varredura da proteína.
Os experimentos foram realizados com um MicroCal iTC200. A célula de amostra foi preenchida com 250 µL de 10 ou 25 mg/mL ProX, e a seringa de titulação foi preenchida com 40 µL de 60 nM fenol ou 50 mM polissorbato-80 no mesmo tampão do ProX. A célula de referência foi preenchida com água deionizada. Para cada experimento, foram injetados 40 µL de titulante na célula de amostra em alíquotas de 0,2 a 2 µL a uma taxa de 0,5 µL por segundo. As seguintes medidas foram utilizadas: velocidade de mistura 1000 rpm, potência de referência 5 a 8 μCal por segundo, modo/ganho de retorno definido como alto, temperatura 25 °C, atraso inicial de 60 segundos. Operações de controle de tampão em tampão, diluição de titulação e diluição de ProX foram subtraídas de cada experimento. Os dados foram analisados com o Origin versão 7 para ITC. Antes do uso das amostras para testes de ITC, as amostras foram filtradas utilizando filtros de seringa de baixa ligação de proteína de 0,2 μm (Pall Life Sciences), e cada uma das amostras de proteína foi dialisada no mesmo tampão utilizado para preparar a solução de excipiente e garantir um tampão compatível com a seringa e a célula.
A ligação direta de excipientes com o ingrediente ativo de um produto farmacêutico pode afetar o produto de várias maneiras. Estudos recentes demonstraram que os excipientes comumente utilizados em formulações farmacêuticas podem afetar a farmacocinética das drogas ativas (4, 5). Também há a possibilidade de os excipientes alterarem a estrutura ou biodisponibilidade do fármaco de proteína, resultando em alterações de potência. Além de uma possível alteração na farmacocinética ou potência do ingrediente ativo, as interações de excipiente/proteína também podem afetar a vida útil do fármaco. Assim, a interação da proteína com os excipientes da formulação precisa ser reconhecida e compreendida. Se a interação direta (p.ex., ligação mensurável) for detectada entre a proteína e os excipientes da solução, será necessário considerar duas características importantes durante o planejamento da formulação de um fármaco de proteína: primeiro, força e/ou reversibilidade da ligação do excipiente à proteína, o que pode esconder ou totalmente ocultar um local ativo crítico da superfície da proteína após a administração clínica; e segundo, a concentração do excipiente não ligado, que precisa ser suficiente para a obtenção das propriedades de solução desejadas. Cada um desses aspectos é exemplificado abaixo para o ProX.
A figura 1 mostra os resultados de um experimento ITC em que foram injetados 50 mM de polissorbato-80 em 25 mg/mL de ProX. Os dados brutos no painel (A), e os aquecimentos integrados por injeção, após a subtração dos testes de controle, estão no painel (B). Os dados no painel (B) mostram que realmente há uma interação mensurável entre polissorbato-80 e ProX. Os dados foram ajustados com um modelo de local simples com a constante de afinidade de ligação (KA) = 1430 ± 260 M-1, entalpia de ligação (ΔH) = -6,3 ± 1,1 kcal/mol, e número de locais de ligação (n) por molécula ProX igual a 2,6 ± 0,3. A alteração de entropia de ligação (ΔS) foi calculada, resultando em -6,7 ± 3,7 cal/mol-K.
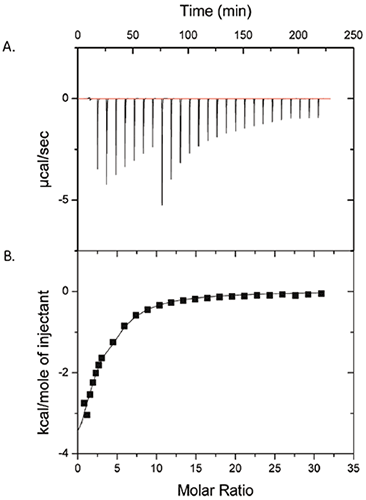
|
Com base na curva isotérmica (Fig 1), a conclusão foi que os locais de ligação de polissorbato-80 em ProX se tornaram saturados a uma proporção molar de polissorbato-80 por molécula de ProX de aproximadamente 10. A concentração micelar crítica (cmc) de polissorbato-80 é 0,012 mM em água pura, atingindo níveis que chegaram a 0,1 mM em soluções de proteína (2). A concentração de polissorbato-80 no experimento de ITC da Figura 1 abrangeu 0,1 a 7 mM, acima da cmc mesmo após a primeira injeção. Essas informações são importantes, já que qualquer interação detectável seria atribuída à ligação da proteína às micelas surfactantes, e não ao monômero.
No desenvolvimento de formulação, é útil conhecer os parâmetros de ligação para determinação da concentração mais baixa possível de excipiente ligado necessário para "saturar" a proteína e obter o efeito estabilizante. A redução da concentração de excipiente em uma formulação diminui os custos, assim como o nível de aditivos que serão administrados ao paciente. Nesse estudo de caso em particular, um excesso molar de 10 dobras de polissorbato-80 por molécula de proteína foi suficiente para saturar a proteína. Os parâmetros de ligação também podem ser utilizados para prever o comportamento in vivo do complexo proteína-excipiente; assim, as constantes de afinidade de ligação fraca medidas pela ITC sugerem que o complexo ProX/polissorbato-80 será dissociado devido à diluição na entrada da corrente sanguínea, sem efeito algum à atividade biológica do fármaco de proteína.
O fenol é utilizado como um agente antimicrobiano em formulação ProX. A ITC foi utilizada aqui para avaliar a termodinâmica de qualquer ligação mensurável entre a proteína e o conservante. A figura 2 mostra um gráfico de calor por injeção em relação à proporção molar da titulação de 60 mM fenol em10 mgmL ProX a um pH 5,7, 4,5 e 3,5, após a subtração dos experimentos de controle.
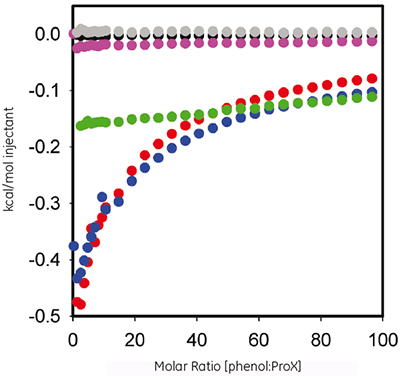
|
Os dados da ITC mostram que ProX em pH 5,7 e 4,5 interage fenol, mas não a pH 3,5. Não possível ajustar as curvas isotérmicas resultantes em qualquer um dos modelos de ligação predefinidos, o que indica que o evento de ligação é complexo e envolve locais múltiplos.
A figura 3 mostra os traços de DSC para 1 mg/mL ProX nos tampões da formulação idênticos aos utilizados nos experimentos da ITC. Os dados de DSC correspondentes mostram que, na ausência de fenol a pH 5,7, ProX teve pelo menos três transições de desdobramento com temperaturas de desdobramento de ponto intermediário Tm1, Tm2, Tm3 iguais a 59 °C, 68 °C e 85°C, respectivamente, com a transição intermediária representando o evento de desdobramento principal. A entalpia total de desdobramento (ΔHunf) foi 270 kcal/mol. A pH 4,5 a primeira transição não foi detectável. O principal evento de desdobramento teve Tm2 igual a 55 ºC, e Tm3 diminuiu para 73 °C. O ΔHunf diminuiu para 216 kcal/ mol, o que sugere uma redução na força das interações terciárias. Finalmente, a pH 3,5, ProX foi desdobrado por ácido, conforme indicado pela ausência de quaisquer transições de desdobramento detectáveis nos dados da DSC.
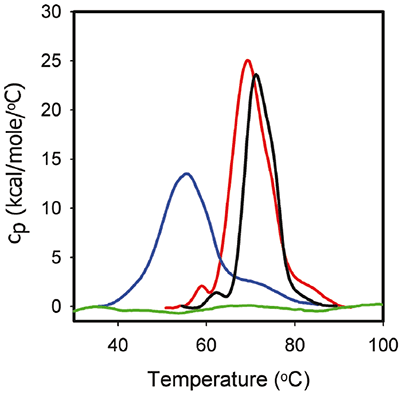
|
A figura 3 também representa o termograma DSC de desdobramento de ProX na presença de fenol a pH 5,7. É possível observar que o fenol aumentou Tm1 a 1 °C e Tm2 a 2 °C e diminuiu ΔHunf para 195 kcal/mol. No entanto, a estrutura terciária de ProX foi a mesma na presença e ausência de fenol (determinado pelos dados de caracterização adicionais, como fluorescência, dados não mostrados). Em geral, as alterações no comportamento da DSC podem ser correlacionadas às alterações na estrutura por outros métodos; porém, nem sempre esse é o caso. Acredita-se que as alterações na DSC se originem da quebra das forças que estabilizam a estrutura da proteína nativa (como van der Waals, interações hidrofóbicas e eletrostáticas, ligações de hidrogênio etc.) e a hidratação de resíduos expostos. A desestabilização das interações terciárias pode reduzir a compactação da proteína, que é detectada pela DSC, sem a indução de alterações estruturais que são detectáveis por outros métodos analíticos.
Essa combinação de dados de ITC e DSC revelou informações significativas sobre as interações fenol-proteína. Primeiro, o fenol se liga a ProX dobrado, mas não se liga a ProX desdobrado (Fig 2); é, portanto, importante que a estrutura terciária esteja intacta para que ProX tenha locais de ligação disponíveis para fenol. Segundo, como é crítico que a estrutura terciária da proteína esteja intacta para atuação, pH 5,7 parece ser o pH de formulação ideal. Terceiro, conforme observado na figura 2, a ligação de fenol a ProX alcança a saturação total a proporções molares superiores a 50. Quarto, os testes de DSC (1 mg/mL ProX em pH 5,7 tampão de formulação com 0,005% (v/v) fenol) foram realizados a um fenol calculado: proporção molar de ProX de 38, que estava próxima à, mas não na, saturação total. Quinto, embora os locais de ligação não estivessem saturados, essa proporção molar de fenol foi suficiente para aumentar a estabilidade termal de ProX.
Foi observado que o fenol apresentou uma redução na atividade antimicrobiana na presença de ProX (dados não mostrados). Essa observação, associada ao conhecimento de que o fenol se liga a ProX, indica que o fenol ligado não tem nenhuma, ou pouca, atividade antimicrobiana comparado ao fenol não ligado. Com a ajuda da curva de ligação, foi possível selecionar uma concentração de fenol acima do ponto de ligação-saturação para a formulação, em que a concentração de fenol não ligado permitiria a atividade antimicrobiana eficiente. Não foram previstos inicialmente os valores acentuados de Tm para ProX na presença de fenol; no entanto, isso indica uma maior estabilidade térmica e sugere uma estabilidade em longo prazo otimizada da proteína. Não é possível estabelecer correlações diretas entre estabilização induzida por fenol e a eficiência antimicrobiana do fenol.
Utilizando ITC e DSC, foi identificada e caracterizada termodinamicamente a ligação de fenol a ProX dobrado a pH de 5,7 e de polissorbato-80 para ProX. A constante de ligação medida para ProX para polissorbato-80 classifica a interação como fraca; dessa maneira, seria possível prever a dissociação in vivo da proteína ativa dos excipientes estabilizantes na formulação, juntamente com a interferência induzida por excipiente com os efeitos biológicos completos do fármaco de proteína. Com base na curva de saturação de titulações ProX-fenol, é possível identificar uma concentração de fenol acima do ponto de saturação para criar uma formulação com capacidade antimicrobiana ideal e melhor estabilidade térmica. Não somente a ligação do excipiente hipotética foi confirmada, mas também foram identificadas as concentrações adequadas para esses dois excipientes (a um excesso molar de 10 dobras de polissorbato-80 por molécula de ProX a concentrações superiores a cmc, e um excesso molar de 50 dobras de fenol por molécula de ProX).
Os requisitos para formulações de produtos de proteína incluem segurança e eficácia. A adição de excipientes para fins de criar produtos terapêuticos de proteína eficientes e seguros, assim como, aperfeiçoar a estabilidade do produto e vida útil requer um entendimento das interações entre a proteína e os excipientes a um nível molecular. Nessa nota de aplicação, a ITC e DSC permitiram a caracterização de ligações proteína-excipiente como uma das muitas interações possíveis em uma formulação de solução de proteína complexa.
Arakawa, T., et al, Factors affecting short-term and long-term stabilities of proteins. Adv. Drug Deliv. Rev. 46, 307-326 (2001).
Chou, D. K., et al, Effects of Tween 20 and Tween 80 on the stability of Albutropin during agitation. J. Pharm. Sci. 94, 1368-1381 (2005).
Bam, N. B., et al, Tween protects recombinant human growth hormone against agitation-induced damage via hydrophobic interactions J. Pharm. Sci. 87, 1554-1559 (1998).
Ren, X., et al, Pharmaceutical excipients inhibit cytochrome P450 activity in cell free systems and after systemic administration. Eur. Jour. Pharm. Biopharm. 70, 279-288 (2008).
Taheri-Kafrani, A., et al, T. Beta-lactoglobulin structure and retinol binding changes in presence of anionic and neutral detergents. J. Agric. Food Chem. 56, 7528-7534 (2008).