O que é Potencial Zeta? -1: Introdução ao Método de Medição do Potencial Zeta
Introdução
O potencial zeta é uma propriedade física que descreve todas as partículas dentro de uma suspensão. Ele também pode indicar claramente o comportamento de suspensões e emulsões. Compreender o potencial zeta ajuda a reduzir o tempo necessário para criar formulações de teste. Além disso, ele permite prever a estabilidade a longo prazo.
Ciência dos Colóides
As três formas fundamentais de matéria são sólido, líquido e gasoso. Quando uma dessas formas está dispersa de maneira refinada em outro, é chamado de sistema coloidal. Esses materiais apresentam propriedades especiais de grande importância prática.
O sistema coloidal inclui vários exemplos como aerossóis, emulsões, suspensões coloidais e colóides de associação. Em algumas condições, as partículas em dispersão se juntam formando agregados, que crescem em tamanho e ficam sob a influência da gravidade.
O aglomerado inicial formado é chamado de floco, e o processo de formação desse aglomerado é denominado floculação. Os flocos podem ou não levar à sedimentação ou separação de fases.
Quando esses agregados tornam-se mais densos, ocorre coagulação.
A ligação entre partículas ocorre quando a densidade do agregado excede a do meio, resultando em sedimentação; se a densidade for menor, forma-se uma camada de creme, ocorrendo separação.
O processo de coagulação geralmente difere de floculação reversível ao ocorrer defloculação irreversível.
Este processo é ilustrado na Figura 1.

Estabilidade Coloidal e Teoria DVLO
Em 1940, os cientistas Derjaguin, Verwey, Landau e Overbeek desenvolveram uma teoria sobre a estabilidade dentro de sistemas coloidais. A teoria DVLO propõe que a estabilidade das partículas em solução depende da função total de energia das partículas, ![]() .
.
![]() é determinado por várias contribuições listadas abaixo.
é determinado por várias contribuições listadas abaixo.
![]()
![]() é a energia potencial devido ao solvente, e a última é uma pequena contribuição para a separação de algumas nanopartículas. O fator mais importante é o equilíbrio entre
é a energia potencial devido ao solvente, e a última é uma pequena contribuição para a separação de algumas nanopartículas. O fator mais importante é o equilíbrio entre ![]() e
e ![]() , representando a distribuição de forças atrativas e repulsivas. Potencialmente, uma energia maior e que influencia em distâncias maiores é indicada por
, representando a distribuição de forças atrativas e repulsivas. Potencialmente, uma energia maior e que influencia em distâncias maiores é indicada por ![]() .
.
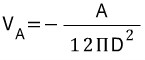
É representado como A é a constante de Hamaker e D representa a separação das partículas.
O potencial que representa forças repulsivas, ![]() , tem uma fórmula mais complexa.
, tem uma fórmula mais complexa.
![]()
a é o raio da partícula, π é a solubilidade do solvente e κ é a composição iônica, ζ é uma função que representa o potencial zeta.

A teoria DVLO postula que a estabilidade em sistemas coloidais é determinada pela soma das forças de van der Waals atrativas e das forças de repulsão devido à dupla camada elétrica entre partículas em movimento browniano. Essa teoria descreve a barreira de energia que impede que duas partículas se unam, comparando a repulsão e atração que ocorrem quando elas se aproximam.
Entretanto, partículas que não superam essa barreira energética ficam irremediavelmente unidas pela força de atração. Se as partículas tiverem repulsão suficientemente alta, a dispersão evitará aglomeração, garantindo a estabilidade do sistema coloidal.
Se não houver mecanismos de repulsão, ocorrerá aglomeração e coagulação, levando eventualmente à sedimentação.

Quando o potencial zeta diminui (caso de alta concentração salina), há potencial para a ocorrência de “segundos mínimos” de ligações mais fracas e potencialmente reversíveis entre as partículas (Figura 2 (b)).
Este floco mais fraco é estável o suficiente para não ser rompido pelo movimento browniano, mas a aplicação de forças externas como agitação forçada pode causar dispersão.
Portanto, para manter a estabilidade de um sistema coloidal, a força de repulsão deve ser preponderante. Como alcançar a estabilidade do sistema coloidal?
Existem dois mecanismos fundamentais que afetam a estabilidade de dispersões.
Repulsão estérica – Isso envolve polímeros que adsorvem na superfície das partículas, impedindo que as superfícies das partículas se aproximem. Quando a adsorção é suficientemente alta, a repulsão estérica entre as camadas poliméricas ajuda a manter suficiente separação entre as partículas para que forças de van der Waals sejam fracas demais para causar aglomeração.

Estabilidade eletrostática ou de carga – Refere-se aos efeitos da interação entre partículas devido à distribuição de carga no sistema. Cada mecanismo tem vantagens específicas para sistemas individuais. A estabilidade estérica é simples e eficaz quando um polímero apropriado está presente.
No entanto, polímeros podem ser caros e, em alguns casos, como em deslizamentos cerâmicos, eles são queimados durante a moldagem e a sinterização, o que torna este mecanismo inadequado. Além disso, isso pode causar retração e outros defeitos. A estabilidade eletrostática ou de carga, por outro lado, simplifica o processo de ajuste da densidade iônica dentro de um sistema simples e pode ser vantajosa em sistemas de floculação.
É um processo reversível e não é caro. O potencial zeta tem sido um bom indicador da força de interação entre partículas coloidais por muito tempo. Medir o potencial zeta é amplamente usado para verificar a estabilidade do sistema coloidal.
Carga Superficial
A maioria das dispersões coloidais em meio aquoso carrega uma carga. Existem muitas causas possíveis para a carga superficial das partículas, dependendo da natureza básica da partícula e do ambiente ao seu redor, mas consideraremos os mecanismos mais importantes.
Ionização de Grupos Superficiais
A dissociação de grupos ácidos na superfície das partículas dá origem a cargas negativas na superfície, enquanto o processo oposto, a dissociação de grupos básicos, leva a cargas positivas sobre a superfície das partículas.
Este artigo pode ter sido traduzido automaticamente
{{ product.product_name }}
{{ product.product_strapline }}
{{ product.product_lede }}
