A estabilidade de uma proteína terapêutica candidata é fundamental para o sucesso ou a falha de seu desenvolvimento. A estabilidade da proteína afeta sua produção, fabricação, formulação, armazenamento a longo prazo, administração ao paciente e eficácia. Proteínas altamente estáveis tendem a apresentar menos problemas durante a fabricação, são mais econômicas e têm uma probabilidade maior de continuar funcionais durante o processo de formulação e armazenamento. Na abordagem QbD (Quality by Design) para o desenvolvimento de produtos biofarmacêuticos, a caracterização da estabilidade faz parte da avaliação inicial da capacidade de desenvolvimento ou viabilidade de uma molécula candidata e é constantemente reavaliada durante o desenvolvimento do processo e a fabricação. Os dados de estabilidade também estão incluídos na caracterização da estrutura de ordem superior (HOS) e nas "impressões digitais" utilizadas no apoio à produção, na comparabilidade biofarmacêutica e na biossimilaridade. A caracterização da HOS das proteínas está se tornando uma inclusão padrão na apresentação de novos medicamentos biofarmacêuticos e biossimilares.
Devido à natureza complexa das proteínas, as ferramentas de caracterização biofísica são importantes para a análise de um produto biofarmacêutico. Existe uma variedade de ferramentas biofísicas que são comumente usadas para avaliar a estabilidade das proteínas, incluindo, entre outras, dicroismo circular (CD), espalhamento de luz dinâmico e estático (DLS e SLS), cromatografia por exclusão de tamanho com detector de espalhamento de luz multiangulo (SEC-MALS), espectroscopia no infravermelho por transformada de Fourier (FTIR), ultrafiltração analítica (ASC), cromatografia por exclusão de tamanho (SEC), fluorescência de varredura diferencial (DSF), fluorescência intrínseca (IF) e calorimetria de varredura diferencial (DSC).
Embora todas essas tecnologias desempenhem um papel importante no desenvolvimento biofarmacêutico, a caracterização da estabilidade térmica por DSC é fundamental. Em um artigo de 2015 sobre técnicas biofísicas usadas para a caracterização da estrutura de ordem superior, Gokarn et al. afirmou que “a DSC continua sendo uma técnica incomparável para avaliar a estabilidade termodinâmica de proteínas em uma determinada condição de tampão”[1].
Este documento se concentra no uso da DSC para caracterizar a estabilidade térmica de produtos biofarmacêuticos a base de proteínas (principalmente, anticorpos) durante o desenvolvimento de pré-formulação e formulação, a fim de selecionar as condições de solução em que a proteína está, preferencialmente, em sua conformação nativa e dobrada para produzir um medicamento estável e eficaz.
A DSC é uma técnica de microcalorimetria utilizada para caracterizar a estabilidade conformacional e térmica das proteínas, ácidos nucleicos, lipídios e outros biopolímeros [2-7]. A DSC mede a capacidade de aquecimento em função da temperatura. Os instrumentos de DSC utilizados na caracterização de proteínas descrita neste documento são instrumentos de compensação energética, com uma célula de amostra fixada contendo o biopolímero no tampão e uma célula de referência preenchida com o mesmo tampão. O sinal da capacidade de aquecimento (Cp) da célula de amostra é comparado com o da célula de referência. Conforme a temperatura das células aumenta, as diferenças de temperatura entre as células de referência e de amostra são continuamente medidas e calibradas a unidades de energia. A DSC é conhecida como um “ensaio de degradação forçada”; conforme a proteína é exposta ao aumento da temperatura, ela começa a se desdobrar e o Cp da proteína aumenta de forma correspondente (Figura 1).
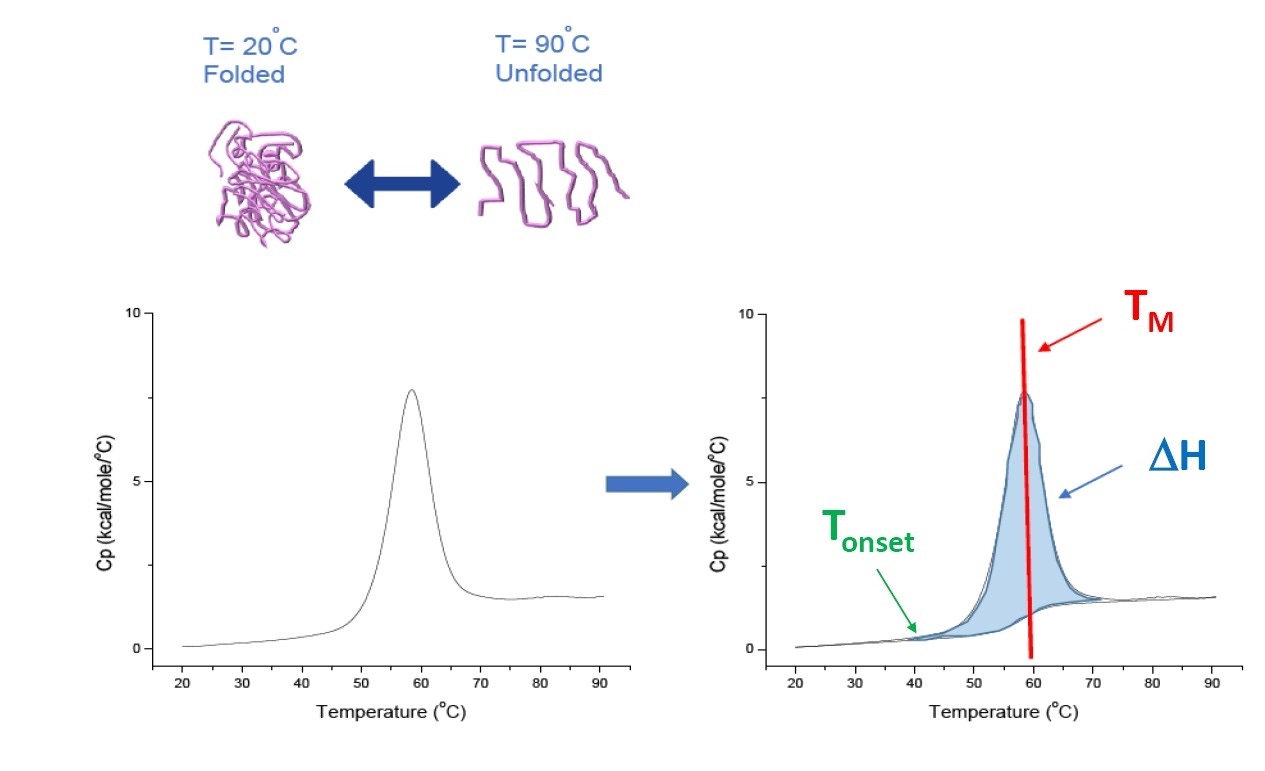
Figura 1: Como a DSC funciona: a capacidade de aquecimento (Cp) muda conforme a proteína desnatura termicamente. O experimento da DSC começa a uma temperatura na qual a proteína é primeiramente dobrada em sua conformação nativa. Com o aumento da temperatura, em algum momento a proteína vai começar a desdobrar/desnaturar (Tinício) e a Cp vai aumentar. Na temperatura em que 50% das proteínas estão em sua conformação nativa e 50% estão desnaturadas, a Cp atinge o seu valor máximo - este é o ponto médio de transição térmica, ou TM. Acima do TM, as proteínas estarão principalmente desnaturadas e, no fim do experimento de DSC, todas as proteínas estarão em sua conformação desdobrada. Os parâmetros experimentais para a DSC incluem o Tinício, o TM e a entalpia de desdobramento (ΔH).
A DSC mede diretamente a alteração da capacidade de aquecimento, sem a necessidade de fluorescência ou qualquer outra marcação ou sonda. Para uma proteína que se desnatura de forma reversível, o ponto médio de transição térmica (TM), também chamado de temperatura de fusão ou desnaturação, é a temperatura na qual a proteína está em equilíbrio conformacional, com 50% em sua conformação nativa (dobrada) e 50% em sua conformação desnaturada. O TM é visto como o “pico” de um termograma de DSC.
O TM é considerado uma boa indicação da estabilidade térmica: quanto maior for o TM, mais termicamente estável estará a proteína. As proteínas de vários domínios (como os anticorpos) geralmente produzem mais de um pico em um termograma de DSC; portanto, mais de um TM pode ser determinado (consulte a Figura 2 para obter um exemplo).
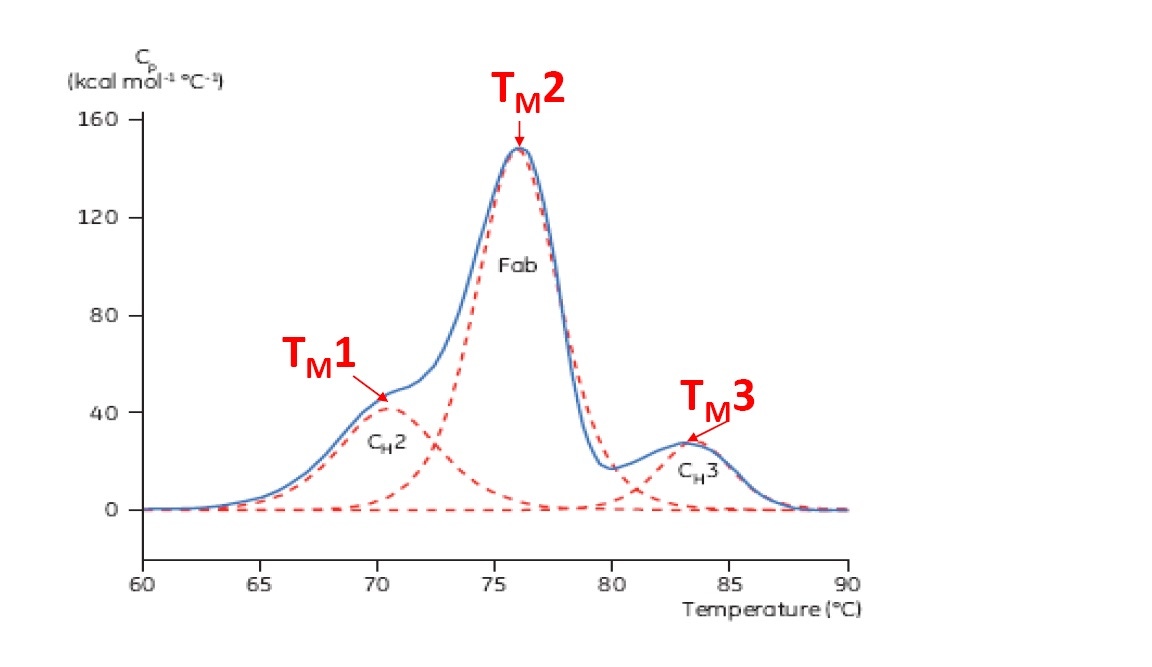
Figura 2: Termograma de DSC representativo de um anticorpo monoclonal, com os domínios CH2, Fab e CH3 identificados. As linhas vermelhas tracejadas são os picos com deconvolução da transição de cada domínio, com os três TMs indicados.
A DSC fornece outros parâmetros úteis, que podem ser usados para caracterizar e classificar a estabilidade das proteínas, incluindo a entalpia do desdobramento (ΔH), que é medida pelo área sob a curva. O desdobramento das proteínas é um processo endotérmico, pois é necessária a aplicação de energia para quebrar as ligações não-covalentes secundárias que mantêm a proteína dobrada corretamente. A DSC também determina o Tinício (início do desdobramento), ΔCp (alteração da capacidade de aquecimento do desdobramento) e T1/2 (largura à meia altura do pico, indicativo da forma do termograma do desdobramento). A análise por DSC pode incluir a determinação de qualquer combinação destes parâmetros.
A maioria das proteínas desnatura de forma irreversível e tende a agregar ou precipitar quando aquecida. O TM e os outros parâmetros resultantes da análise por DSC das proteínas desnaturadas de forma irreversível não são parâmetros termodinâmicos verdadeiros. Entretanto, a classificação dos TMs da análise por DSC da desnaturação irreversível da proteína é um parâmetro qualitativo muito útil para a avaliação da estabilidade.
A Malvern Instruments oferece o sistema de MicroCal VP-Capillary DSC[8,9], que é um Calorímetro de Varredura Diferencial automatizado projetado para avaliação do TM e caracterização termodinâmica de proteínas e biopolímeros em solução.
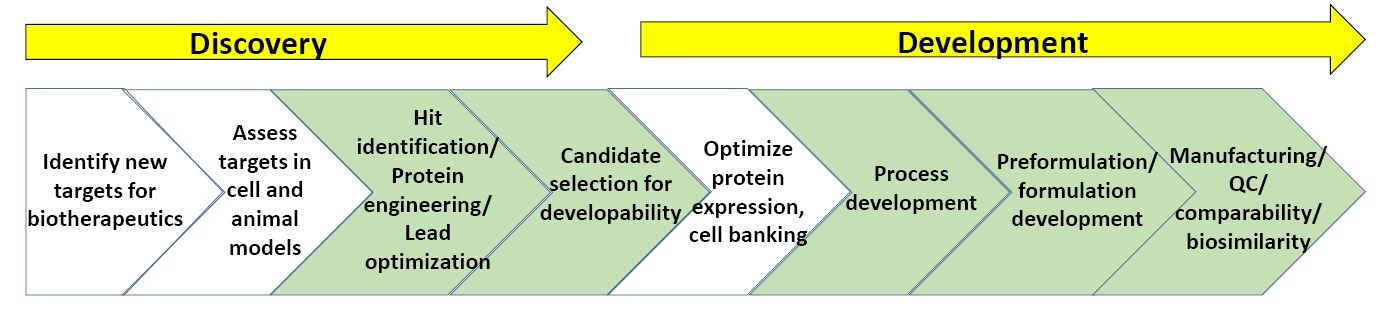
Figura 3. Esquema geral dos processos na descoberta e no desenvolvimento de produtos biofarmacêuticos.
A Figura 3 mostra um esquema geral das fases de descoberta e desenvolvimento de produtos biofarmacêuticos. As seções em verde destacam os pontos em que a caracterização biofísica, incluindo os estudos de estabilidade, são mais comumente utilizados (além disso, no final deste documento há uma lista de “leitura sugerida” sobre a descoberta e o desenvolvimento de produtos biofarmacêuticos).
A sequência de aminoácidos que cria uma cadeia de polipeptídeos é conhecida como a estrutura primária (1ª) da proteína. Além disso, há 3 níveis adicionais da estrutura de ordem superior (HOS), que é importante caracterizar para compreender totalmente a estabilidade, a funcionalidade, a atividade e a natureza geral da proteína. A estrutura secundária (2ª) da proteína se refere aos padrões de dobramento local da estrutura primária de uma proteína, incluindo α-hélice, folha-β, voltas e giros aleatórios; a estrutura terciária (3ª) refere-se à estrutura final tridimensional de uma proteína decorrente de um conjunto de elementos estruturais secundários; por fim, a estrutura quaternária (4ª) descreve os resultados da interação de duas ou mais cadeias polipeptídicas idênticas ou diferentes.
A forma mais comum de administração de produtos bioterapêuticos é a via subcutânea (SC). Medicamentos a base de proteínas administrados por via subcutânea devem ser estáveis e permanecer inalterados em altas concentrações de proteínas (acima de 100 mg/mL) em seus recipientes, (por exemplo, frasco ou seringa pré-preenchida), geralmente por vários anos. Com isso em mente, para criar um produto biofarmacêutico desejável, os cientistas primeiramente procuram biomoléculas que já demonstram alta estabilidade na seleção de candidatos; contudo, ao longo dos processos de desenvolvimento e fabricação, há muitos fatores que podem afetar a estabilidade de uma molécula, o que significa que pode ser necessário aumentar a estabilidade através da engenharia de proteínas.
O processo de purificação envolve a remoção das proteínas de condições em que estão estáveis, dobradas corretamente e ativas; portanto, é importante adaptar cuidadosamente os tampões, aditivos, métodos de purificação e condições de armazenamento para manter a proteína o mais estável possível neste ponto. Quando as moléculas de proteínas são expostas a fatores estressantes, como calor, produtos químicos, alterações de pH, pressão, mistura e alta concentração, o que ocorre com frequência durante o processo de formulação biofarmacêutica e produção, suas conformações podem favorecer a forma desnaturada (desdobrada).
As proteínas na solução também são suscetíveis a modificações como a desamidação e a oxidação, o que pode levar a proteínas desnaturadas e inativas. No caso de produtos biofarmacêuticos a base de proteínas, a desnaturação ou outras modificações podem resultar na formação de agregados que levam a produtos com eficácia reduzida ou medicamentos não funcionais. Talvez o mais significativo seja a crescente evidência do papel que a agregação de proteínas pode ter na produção indesejada de respostas imunogênicas fatais nos pacientes. O uso de proteínas inerentemente estáveis resulta em uma produção mais econômica, bem-sucedida, eficiente e segura de medicamentos.
A DSC fornece uma visão geral detalhada da estabilidade conformacional e das alterações nas estruturas terciárias e quaternárias que ocorrem quando uma proteína é desnaturada termicamente, bem como informações sobre como os fatores intrínsecos e extrínsecos podem afetar a estabilidade das proteínas. A DSC é considerada o melhor e mais quantitativo ensaio para a caracterização da estabilidade térmica de proteínas biofarmacêuticas e é frequentemente utilizada como preditor de uma estabilidade a longo prazo[1,10-14]. Os TMs gerados usando DSC são parâmetros frequentemente usados para classificar a estabilidade na seleção de candidatos (capacidade de desenvolvimento), na avaliação da formulação e no desenvolvimento do processo. A entalpia (ΔH), o Tinício, o T1/2 e o ΔCp da DSC também são usados para classificar a estabilidade, na validação dos dados de DSC, na análise qualitativa do desdobramento das proteínas e nas "impressões digitais” da estrutura de ordem superior[10-14].
A análise por DSC para proteínas altamente semelhantes em condições de solução definidas é reproduzível e quantitativa (Figura 4). Ou seja, os termogramas de DSC terão um perfil semelhante e os parâmetros (incluindo TM, ΔH e Tinício) estarão dentro de uma faixa aceita[12-14]. Se os termogramas parecerem diferentes e os parâmetros de ajuste da DSC mudarem, isto pode sugerir que um evento como o dobramento incorreto da proteína, degradação, agregação, diferenças no tampão, alterações na modificação pós-translação ou outra alteração estrutural de ordem superior ocorreu, afetando a estabilidade conformacional da proteína.
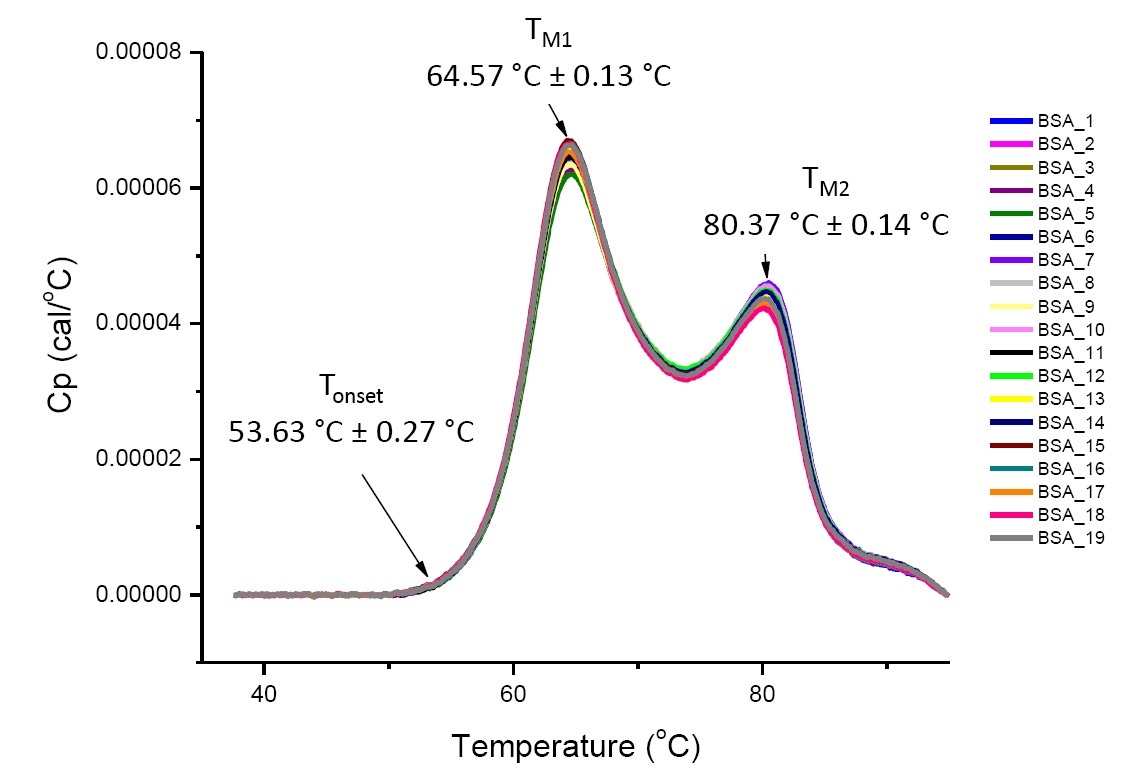
Figura 4: Dezenove termogramas de DSC de albumina sérica bovina (Sigma A1933, purificada por cromatografia) em PBS. Dados da DSC mostrados após a normalização da velocidade de varredura, subtração tampão-tampão e integração e subtração da linha de base. A média e o desvio padrão do Tinício, TM1 e TM2 são mostrados.
Resultados reproduzíveis e quantitativos tornam a DSC uma ferramenta valiosa para a caracterização da HOS na avaliação do produto durante a fabricação (incluindo comparabilidade entre lotes e locais), na comparação de variantes de proteínas e produtos modificados (incluindo mudanças estruturais devido a glicosilação, desamidação e oxidação) e na biossimilaridade. Dados da DSC também são usados nos documentos regulatórios de apoio como parte da caracterização da HOS para apresentações de novos medicamentos e biossimilares. Em uma pesquisa realizada por cientistas biofarmacêuticos, a DSC foi classificada como uma técnica de análise biofísica “muito útil” a “extremamente útil” na seleção de candidatos, desenvolvimento de formulação, caracterização do produto, comparabilidade e biossimilaridade[15].
Os valores de TM podem ser determinados de forma muito simplesmente a partir dos picos do termograma de DSC, sem a necessidade de análises de dados complexas. Como já mostrado (Figura 2), para proteínas de vários domínios como anticorpos, os termogramas de DSC mostram mais de uma transição de desdobramento. A DSC é capaz de caracterizar e quantificar os diferentes domínios e pode determinar os TMs para duas, três ou mais transições. Outras ensaios biofísicos que podem determinar o TM, como CD, IF e DSF, somente podem detectar o primeiro TM (que ocorre na menor temperatura) ou o TM mais "dominante” paraproteínas de vários domínios. A extração de mais de um TM a partir dos dados de espectroscopia ou fluorescência requer um ajuste complexo de dados e pode não ser reproduzível.
Em comparação com outros estudos de avaliação de TM, a DSC geralmente exige mais amostras de proteína por análise e pode ter um menor rendimento. Se a amostra for limitada, uma opção seria efetuar uma classificação inicial do TM com DSF ou IF e selecionar várias amostras chave para validar o TM utilizando DSC. É importante que esta etapa de validação da DSC seja realizada e que não sejam considerados somente os resultados de fluorescência ou espectroscopia para a medição do TM nos estudos de estabilidade. Ensaios baseados em fluorescência muitas vezes sofrem com artefatos que interferem nas medições, deslocando os resultados de TM para um valor superior (ou inferior). Além disso, algumas proteínas e condições de tampão não são compatíveis com fluorescência, tornando a DSF e a IF inadequadas. Por fim, a fluorescência e a espectroscopia não são capazes de determinar a entalpia calorimétrica e outros parâmetros termodinâmicos que são fornecidos pela DSC.
A DSC é considerada pelos pesquisadores da indústria biofarmacêutica como o estudo de estabilidade térmica padrão-ouro porque a técnica:
Mede alterações de aquecimento associadas ao desdobramento das proteínas.
É uma medida direta do desdobramento das proteínas, sem a necessidade de marcação, sonda ou tag (como resultado, a DSC não sofre nenhum dos possíveis artefatos de detecção comuns em fluorescência ou em outros estudos espectroscópicos).
É aplicável a proteínas nativas na solução.
Pode ser usada com praticamente todos os tampões e aditivos comuns na purificação e formulação de produtos biofarmacêuticos. Em contrapartida, muitos desses tampões e aditivos são incompatíveis com fluorescência e espectroscopia.
É fácil de configurar e operar.
Apresenta controle de temperatura de alta precisão, com uma faixa operacional de até 130°C, de modo a permitir a detecção da maioria das transições de alto TM. A maioria dos outros estudos de avaliação do TM apenas aquece amostras até 100°C (ou até menos)
É um estudo de degradação forçada e não requer o armazenamento das proteínas em tampões aquecidos antes da análise
Apresenta resultados simples e software de análise de dados integrado
Pode ser usada para resolver transições de desdobramento separadas e caracterizar proteínas de vários domínios e complexos proteicos, bem como proteínas simples de domínio único
É informativa e fornece dados termodinâmicos, além da determinação do TM e da estabilidade conformacional
Pode ser usada como o principal ensaio para caracterização da estabilidade térmica de produtos bioterapêuticos; também pode ser usada com outras ferramentas de avaliação biofísica complementares/ortogonais e/ou para validar outros dados
Encontra-se disponível com automação de alto rendimento (sistema MicroCal VP-Capillary DSC) para uma rápida avaliação da estabilidade térmica
Conforme um medicamento a base de proteína transiciona pelo processo de descoberta ao desenvolvimento, é importante desenvolver uma formulação apropriada, eficaz e ideal, que mantenha sua estabilidade, conformação e eficácia durante o transporte, utilização e prazo de validade desejado. A formulação deve ser econômica para fabricar. Há uma preferência por formulações de proteínas que podem ser autoadministradas para a conveniência do paciente, o que exige que o medicamento seja fornecido e armazenado em uma seringa pré-preenchida ou sistema de fornecimento semelhante que não exija a assistência de um profissional médico; além disso, o armazenamento do medicamento deve estar à temperatura ambiente ou em um refrigerador. Alguns produtos biofarmacêuticos também podem ser fornecido liofilizados (desidratados), o que exige que o medicamento seja solubilizado antes da administração.
No início do ciclo de desenvolvimento, o volume de amostra disponível para os testes é muitas vezes limitado, de forma que algumas empresas realizam um desenvolvimento de pré-formulação, que inclui estudos biofísicos iniciais em pequena escala para definir a melhor composição de tampão e o pH para ajudar a estabilizar as proteínas. Este trabalho ajuda a estabelecer a formulação que será eventualmente usada para avançar o medicamento a base de proteína para os estudos pré-clínicos e clínicos. O desenvolvimento de pré-formulação pode ser conduzido ao mesmo tempo que a seleção de candidatos para a avaliação da capacidade de desenvolvimento do medicamento, já que muitos dos mesmos testes biofísicos estão incluídos em ambos os conjuntos de avaliações.
Durante o desenvolvimento de pré-formulação e subsequente formulação de um medicamento a base de proteína, a proteína é exposta a diferentes condições, incluindo:
Diferentes tampões, valores de pH e concentrações de sais
Aditivos de formulação diferentes (excipientes). Excipientes são materiais inertes que estão presentes em formulações líquidas e liofilizadas para ajudar a estabilizar as proteínas ou ajudar na fabricação ou distribuição de medicamentos. Os excipientes geralmente usados para produtos biofarmacêuticos incluem surfactantes (por exemplo, polissorbato 80), açúcares (por exemplo, trealose), polióis (por exemplo, glicerol), aminoácidos, conservantes e antioxidantes
Altas concentrações de proteínas para medir os níveis aos quais um medicamento candidato pode ser concentrado (em uma gama de tampões e aditivos) antes de ocorrer agregação de proteínas
Condições extremas de temperatura, pressão e umidade
Repetidos ciclos de congelamento/descongelamento e agitação (por exemplo, na presença de interfaces líquidas/ar, estresses de transporte)
Contato com uma variedade de superfícies de materiais diferentes, incluindo o recipiente final (por exemplo, frasco, seringa pré-preenchida, bolsa de IV)
Diferentes níveis de luz
Oxidantes
Testes de armazenamento em tempo real (para avaliar o potencial de estabilidade a longo prazo do medicamento, mantendo-o nas condições de armazenamento pretendidas, geralmente por dois anos) e estudos de estresse acelerado a temperaturas elevadas
Em um artigo de 2016, Kang et al.[16] avaliou trinta e sete formulações que foram usadas com sucesso para anticorpos monoclonais comerciais. O resumo da avaliação observada:
Doze eram formulações liofilizadas e 25 eram formulações líquidas (concentrações na faixa de 2 mg/mL a 200 mg/mL)
Excipientes incluídos: sais, surfactantes, polióis, dissacarídeos, polissacarídeos, aminoácidos e antioxidantes
Acetato, citrato, histidina, fosfato e tampões tris são comumente usados para manter um pH ideal entre 4,7 e 7,4
A maioria das formulações usa um dos três surfactantes mais comuns: polissorbato 80 (Tween 80), polissorbato 20 (Tween 20) e poloxamer 188
Todas as formulações liofilizados incluem açúcares (polióis/dissacarídeos/polissacarídeos), ao passo que 30% das formulações líquidas incluem açúcares
NaCl era usado geralmente
Glicina e arginina são aminoácidos excipientes comumente usados
Uma proteína em solução aquosa está em equilíbrio entre suas conformações nativas (dobradas) e desnaturadas (desdobradas). As interações hidrofóbicas e ligações de hidrogênio são as principais forças de estabilização das proteínas e estas devem ser superadas para a molécula se desdobrar e desnaturar. A entropia conformacional enfraquece as forças estabilizantes, permitindo o desdobramento da proteína. No desenvolvimento de formulação, o principal objetivo é encontrar as condições de solução que ofereçam o maior grau de estabilização e, portanto, permitam a maior proporção de proteínas nativas. Proteínas desnaturadas tendem a ser mais suscetíveis a processos químicos irreversíveis, como proteólise, oxidação e desamidação, que podem, por sua vez, levar à desativação e agregação.
As ferramentas de caracterização biofísica são utilizadas para monitorar a conformação das proteínas, prever a estabilidade térmica e medir a formação de agregados em resposta à formulação e às condições de armazenamento. Muitas das ferramentas biofísicas discutidas nas sessões iniciais deste documento estão incluídas no fluxo de trabalho de desenvolvimento de pré-formulação e formulação. Elas incluem DSC, DSF, DLS, SLS, CD e IF. Estes estudos avaliam a estabilidade das conformações das proteínas (pela determinação do TM, Tinício, perfil de termograma de DSC), HOS, tamanho de partícula e formação de agregados.
A classificação de TM por DSC é usada normalmente como uma seleção inicial do pH, tampões e excipientes da formulação. Normalmente, quanto mais alto o TM medido, mais estável é a proteína na formulação (veja a Figura 5 para obter os termogramas de DSC durante a avaliação de pH de uma proteína), e menor é a probabilidade da formação de agregados no armazenamento (veja os estudos de caso abaixo). A DSC é compatível com praticamente todos os tampões e excipientes usados na formulação de produtos biofarmacêuticos. Mesmo que as transições térmicas de uma proteína sejam irreversíveis na natureza, a DSC é um método conveniente e rápido para classificar o efeito das condições de tampão e excipientes sobre a estabilidade das proteínas em todo o desenvolvimento da formulação.
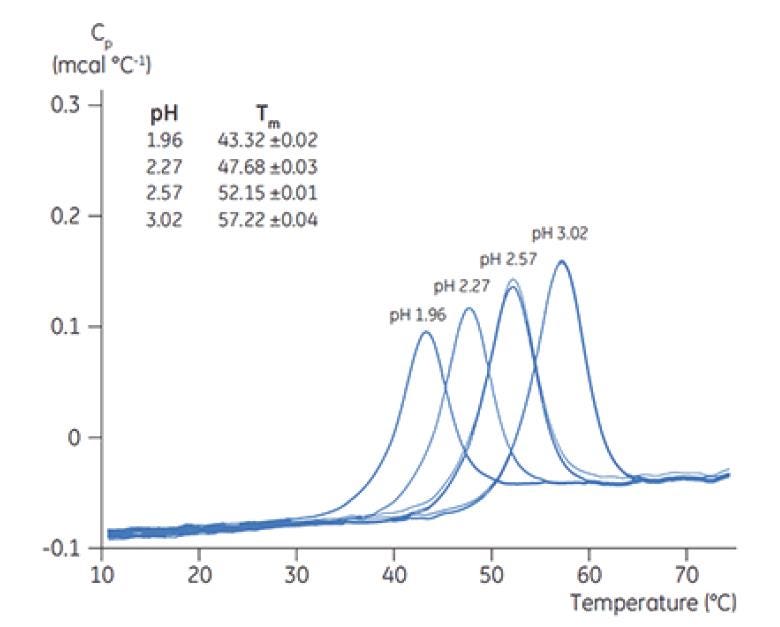
Figura 5. Termogramas de DSC de quimiotripsinogênio em diferentes valores de pH, com TM indicado para cada pH.
Os sistemas MicroCal VP-Capillary DSC foram usados por um número significativo de CMOS e CDMOs importantes para a caracterização da estabilidade conformacional e desenvolvimento de formulação de produtos biofarmacêuticos. Essas empresas incluem a Patheon[16], a Fujufilm Diosynth Biotechnologies[17] e a KBI Biopharma[18].
Os estudos de estabilidade acelerada (ou “testes de estresse”) constituem um elemento comum na seleção da formulação e envolvem o armazenamento da molécula candidata em uma gama de possíveis formulações diferentes, a temperaturas elevadas, e na avaliação delas ao longo de um período de tempo quanto à estabilidade conformacional, tamanho, agregação e possíveis modificações pós-translação, usando SEC, DSC e DLS.
Quando o candidato a produto biofarmacêutico avança pelo processo de desenvolvimento e não há uma quantidade suficiente de proteína disponível, o foco da caracterização passa para os processos envolvidos na formulação final e na produção, bem como nos possíveis efeitos das concentrações de proteínas e dispositivos de administração. Os estudos de estabilidade a longo prazo também são realizados para demonstrar que o medicamento a base de proteína na formulação selecionada tenha vida útil e estabilidade desejáveis. Uma boa formulação manterá o perfil de HOS de um produto biofarmacêutico por, pelo menos, dois anos.
Embora não haja nenhuma garantia absoluta de que a estabilidade térmica sempre estará correlacionada com a estabilidade física de uma proteína durante o armazenamento, um valor maior de TM normalmente indica a necessidade de mais energia para desdobrar a proteína. Quando todas as outras propriedades das proteínas são semelhantes, as formulações de proteína que permitem uma melhor estabilidade térmica são mais desejáveis.
Em 1998, uma publicação de Remmele et al.[19] usou um DSC MicroCal para caracterizar a estabilidade térmica do receptor tipo 1 da interleucina-1 humana recombinante (IL-1R) em tampões incluindo diferentes excipientes. Um estudo de estabilidade acelerada (a 30°C e 50°C) usando IL-1R armazenada em soluções de pH 3 a 9 mostrou quebra mínima de proteínas e agregação em pH 6 (por SDS-PAGE). O termograma de DSC da IL-1R na solução “controle” (citrato de sódio a 20 mM, pH 6,0) mostrou o primeiro TM a 48°C e o segundo TM a 65,5°C. Vinte e três excipientes diferentes foram testados, incluindo açúcares (manitol, lactose, sacarose e glucose) polióis (polietileno glicol, glicerol e etanol), surfactantes (Tween 80, Pluronic F68), sais (NaCl, CaCl2) e aminoácidos (lisina, cisteína, alanina, arginina, glicina). O segundo TM não foi afetado pelos excipientes; portanto, a temperatura da primeira transição térmica foi usada para classificar a estabilidade. A estratégia consistiu em identificar excipientes que aumentariam o TM da transição de temperatura baixa, indicando uma mudança positiva na estabilidade da proteína nativa. A maioria dos excipientes testados resultaram em um deslocamento para baixo no TM (sugerindo uma desestabilização da IL-1R), ou um pequeno deslocamento para cima. O aditivo que criou o maior aumento no TM, sugerindo uma melhora na estabilidade conformacional, foi NaCl a 100 mM, deslocando o primeiro TM de 48,1°C para 53,1°C. Os autores tentaram aumentar as concentrações de NaCl de 100 mM a 1500 mM e continuaram a ver o aumento do TM. Esses resultados sugeriram para os autores que a estabilidade térmica adicional da IL-1R na presença de NaCl ocorreu em virtude das interações diretas do NaCl com a proteína e possivelmente às mudanças na estrutura de água. Uma análise adicional dos excipientes foi realizada na presença de NaCl a 100 mM.
Neste mesmo estudo, os autores analisaram o efeito dos conservantes na estabilidade e agregação da IL-1R. Conservantes são incluídos nas formulações multidose. Usando álcool benzílico, m-cresol e fenol, os termogramas de DSC mostraram que todos os três conservantes desestabilizaram a IL-1R, sendo que o fenol teve o menor impacto na estabilidade térmica e o álcool benzílico teve o maior efeito desestabilizador nos TMs. Esses resultados foram verificados através da análise da formação de agregados por SEC após 7 e 60 dias de armazenamento a 37°C (amostras incluindo fenol apresentaram o menor nível de agregação, enquanto que as incubadas com álcool benzílico mostraram o nível mais alto de agregação).
Remmele e Gombotz[20] demonstraram que a medida do TM por DSC foi um bom preditor da agregação de CD40L. Executando uma avaliação de estabilidade de pH com DSC, os TMs mais altos foram medidos entre o pH 6 e 7,5, o que pode ser correlacionado à faixa de pH que mostrou o menor percentual de formação de agregados, conforme medido por SEC (após armazenamento a 37°C por 7 dias).
Remmele[11] resume outros estudos que utilizaram dados de termogramas de DSC para prever e classificar a estabilidade das proteínas (por exemplo, quimiotripsinogênio e pepsinogênio) em uma variedade de formulações. Remmele também discutiu como o uso da DSC em conjunto com outras técnicas analíticas (SEC-HPLC, CD, AUC, DLS, MS) pode esclarecer a estabilidade conformacional do produto biofarmacêutico em diferentes formulações, e essas informações podem ser usadas para tomar decisões sobre qual formulação deve ser selecionada.
Outros estudos de avaliação de formulações corroboram para o fato de que formulações com valores altos de TM (conforme medido por DSC) tendem a demonstrar níveis menores de agregação quando analisados através de estudos de estabilidade acelerada e SEC-HPLC[21-25].
Burton et al.[26] avaliou o uso da DSC como uma ferramenta para rápida avaliação da estabilidade de anticorpos recombinantes de dois modelos. Alterações no TM foram monitoradas em função do pH e/ou dos excipientes e os resultados foram comparados aos dados de estabilidade acelerada das amostras analisadas por SEC. Os dados produzidos pelo MicroCal DSC corresponderam aos dados obtidos por SEC (as amostras com valores de TM maiores medidos por DSC também mostraram os menores níveis de agregação medidos por SEC); portanto, a DSC foi capaz de determinar o pH ideal da solução e os efeitos dos excipientes na estabilidade da solução. Os valores de pH em que os valores máximos de estabilidade foram previstos por DSC foram o pH 7,5 para a Proteína I e o pH 6 para a Proteína II; esses valores corresponderam bem às previsões dos estudos de estabilidade da solução a longo prazo para cada proteína. Para citar os autores na conclusão do artigo: “Os resultados desses estudos sugerem que a microcalorimetria pode ser uma ferramenta valiosa para a rápida verificação da estabilidade das proteínas em solução, especialmente na fase inicial da caracterização da proteína e desenvolvimento de formulação, quando fornecimentos a granel são, muitas vezes, bastante limitados... Isso pode resultar em economias potenciais significativas em termos de requisitos de substância medicamentosa, bem como no tempo e esforço despendidos na preparação da amostra e análise complexa”[26]
Uma nota de aplicação da Malvern destaca como a Dra. Katherine Bowers (Fujifilm Diosynth Biotechnologies) utiliza a DSC para o desenvolvimento de pré-formulação[27]. O anticorpo X foi colocado em uma gama de tampões de pH 3 a 8 e a análise de DSC (usando DSC MicroCal VP-Capillary) foi executada imediatamente (T= 0), bem como após o armazenamento de 1 semana.
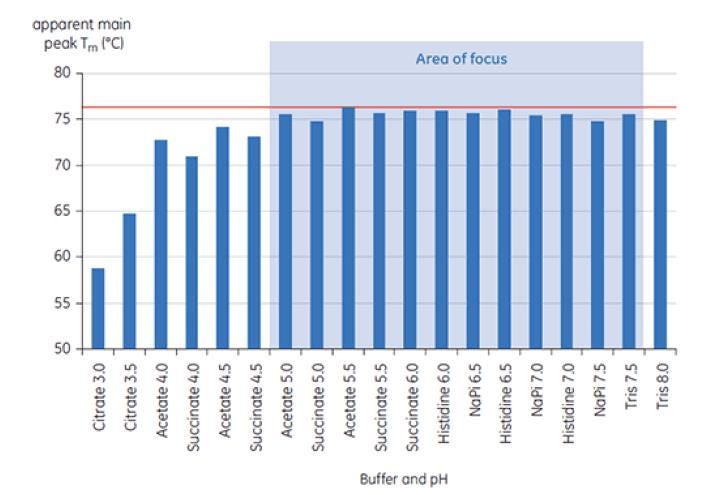
Figura 6: Faixa de valores de TM de anticorpo X em tampões de pré-formulação. As amostras foram analisadas no MicroCal VP-Capillary DSC a T = 0.
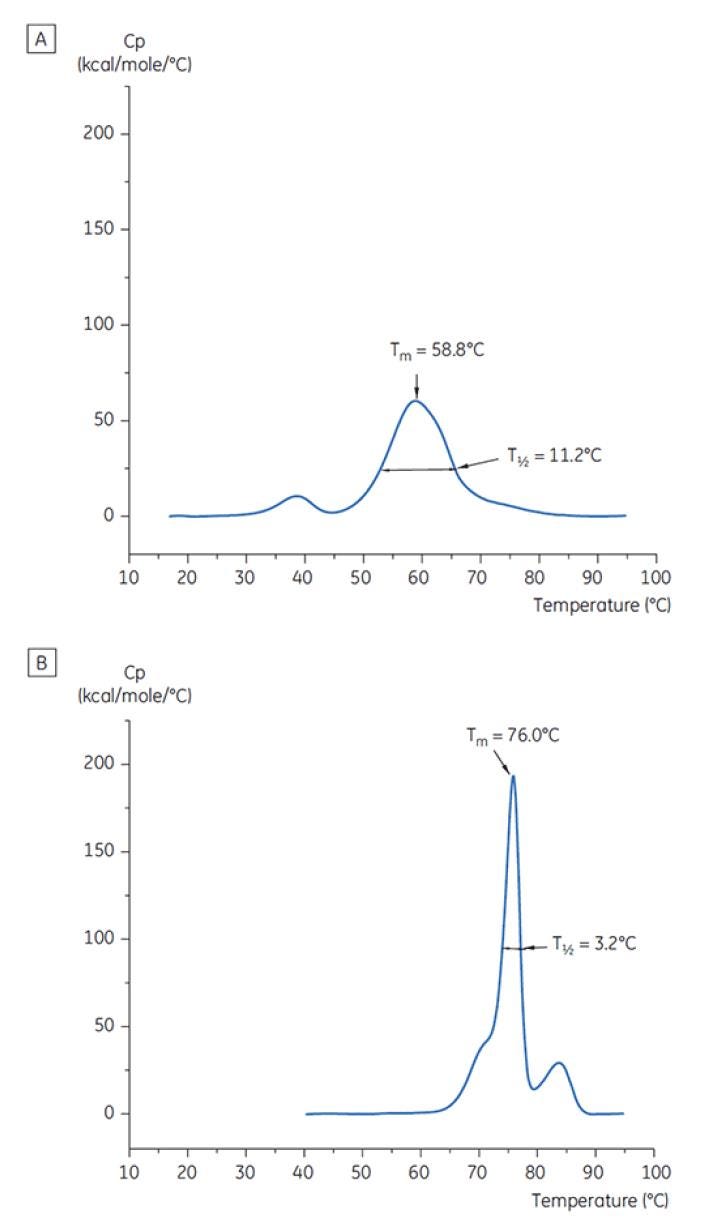
Figura 7: Termogramas da DSC de anticorpo X a T= 0. (A) dissolvido em tampão de citrato com pH 3,0 (B) dissolvido em tampão de succinato com pH 6,0. Os valores de TM e T½ são mostrados para cada um deles.
A Figura 6 mostra o valor do TM principal com pico em T = 0 para o anticorpo X na avaliação inicial da pré-formulação e a Figura 7 mostra o termograma do anticorpo X em tampão citrato, pH 3 e em tampão succinato, pH 6. Dos valores de TM medidos, as condições de tampão mais estáveis (maior TM) foram encontradas entre pH 5,0 e 7,5. Quando T = 0, outros métodos analíticos (UV, cromatografia por exclusão de tamanho [SEC], espalhamento de luz e SDS-PAGE) indicaram muito menos discriminação entre as condições do tampão em relação à DSC (dados não mostrados).
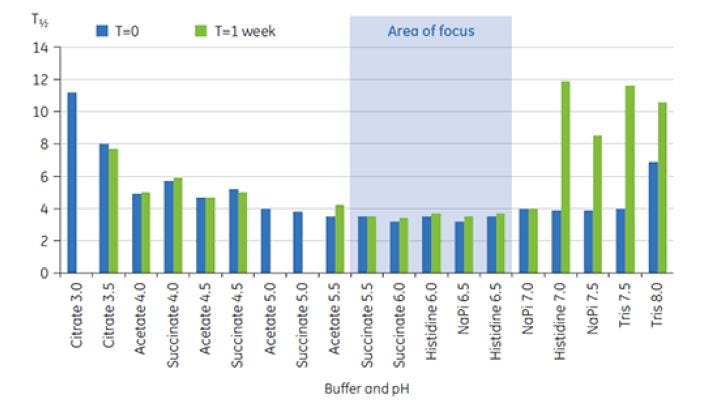
Figura 8: Faixa de valores de T½ para a transição de TM principal de anticorpo X em tampões de pré-formulação a T = 0 e T = 1 semana.
Os valores de T½ foram utilizados para aprofundar a discriminação entre as condições de formulação, conforme indicado na Figura 8. T½ é a largura do pico na metade da altura máxima para a maior transição no termograma da DSC e normalmente reflete a cooperatividade da transição térmica. Um valor T½ mais baixo pode indicar uma estrutura mais compacta e, portanto, é privilegiada em caso de formulações. Aqui, os valores T½ mais baixos foram encontrados após o armazenamento por uma semana para tampões com valores de pH entre 5,5 e 6,5 (figura 8). Esses dados foram utilizados para classificar os tampões apropriados e o intervalo de pH para a seleção de excipientes seguinte, reduzindo o número de condições exploratórias consideravelmente. Esse estudo mostra que a DSC pode ser usada para otimizar rapidamente as condições de pH e tampão no desenvolvimento de pré-formulação.
Um produto biofarmacêutico também é caracterizado em diferentes tampões e excipientes para compreender as possíveis vias de degradação das proteínas. Esta informação ajuda no desenvolvimento da formulação final. Normalmente, medicamentos biofarmacêuticos não são degradados quando armazenados no refrigerador durante o desenvolvimento de formulação, de modo que um estudo de estabilidade acelerada com estresse de temperatura geralmente é realizado, conforme discutido acima em vários exemplos. Um estudo realizado por Zheng et al.[28] examinou a degradação de um AMC-A terapêutico de IgG1. Este grupo inicialmente avaliou o AMC-A em diferentes tampões (fosfato de sódio, citrato de sódio e acetato de sódio), diferentes concentrações de NaCl (20 mM e 100 mM) e diferentes valores de pH (pH 4,5, 5,5, 6,5 e 7,5 ), usando uma DSC MicroCal VP-Capillary. As formulação candidatas mais promissoras de cada grupo de tampões, com base nos maiores valores de TM e Tinício, foram selecionadas para avaliação: fosfato de sódio com pH 6,5 mais NaCl a 20 mM, citrato de sódio com pH 6,5 mais NaCl a 20 mM e acetato de sódio com pH 6,5 mais NaCl a 20 mM. O AMC-A nestes três tampões indicou TMs e Tinício semelhantes, bem como perfis de termograma de DSC praticamente idênticos. Como uma comparação, esse estudo também analisou uma formulação em acetato de sódio com pH 4,5 mais NaCl a 20 mM, que teve uma transição térmica e TM mais baixos.
Os autores armazenaram o AMC-A nas quatro formulações a 40°C e as proteínas ainda foram caracterizadas por SEC (para separar os produtos de degradação da proteína nativa), DLS (para determinar o coeficiente virial secundário modificado a fim de caracterizar interações entre proteínas), LC-MS (para sequenciar os produtos de degradação), cromatografia de interação hidrofóbica (para separar os produtos de degradação da proteína nativa) e SDS-PAGE (para determinar as massas moleculares dos produtos de degradação). Foi descoberto que o armazenamento em tampão com pH 4,5 causou mais fragmentação em comparação ao armazenamento no mesmo tampão com pH 6,5. Além disso, o armazenamento em pH 4,5 induziu o desdobramento do domínio CH2, aumentando a acessibilidade à superfície do AMC-A, o que pode ter facilitado a fragmentação. Apesar de a DSC mostrar que a estrutura conformacional do AMC-A em tampão fosfato com pH 6,5, citrato com pH 6,5 e acetato com pH 6,5 seja semelhante, a DLS mostrou que a potência da interação entre proteínas foi diferente em cada um dos tampões. Interpretados em conjunto, os resultados obtidos com este estudo sugeriram que as interações entre as proteínas tiveram o papel mais importante no controle da formação de agregados no AMC-A. Os autores referem ainda que os conhecimentos obtidos com este estudo foi útil para o desenvolvimento de formulações de AMC-A, mas não devem ser extrapolados para outros AMCs.
A proteólise dos produtos biofarmacêuticos durante a purificação e o armazenamento também podem ser um problema. As proteases da célula hospedeira podem afetar a qualidade das proteínas recombinantes e também podem causar uma perda significativa de produto. Proteínas desdobradas ou parcialmente dobradas são mais propensas à proteólise que proteínas dobradas e proteínas dobradas podem ser estabilizadas contra a proteólise através da adição de osmólitos.
Em um estudo realizado por Mueller, et al.[29], o mecanismo de proteção de uma imunoglobulina M (IgM) contra proteólise foi investigado. IgMs estão surgindo como candidatos terapêuticos, mas têm a reputação de serem inerentemente instáveis. Neste estudo, as proteases pepsina, papaína e α-quimiotripsina foram adicionadas a uma IgM purificada, AMC 85, e a degradação foi analisada na ausência e presença de excipientes. Um aumento na estabilidade conformacional do AMC 85 como resultado da adição dos excipientes glicina e sorbitol foi confirmado utilizando o DSC MicroCal VP-Capillary). O AMC 85 desdobrou nas transições térmicas 2-3 dependes do pH do tampão, sendo que estas transições correspondem a diferentes domínios ou áreas estruturais. Os TMs foram significativamente aumentados pela adição de sorbitol 20% ou glicina 1 M (aumento de 4-5°C) ou ambos (aumento de 7-11°C) com pH 5,5 e 7,4. Isso levanta a questão de como ocorre a proteção por sorbitol e glicina. Uma possibilidade é que as proteases são inibidas pela presença desses excipientes, talvez por compactação de suas conformações padrão. Outra possibilidade é a compactação do IgM, tornando-o menos acessível para clivagem proteolítica.
Para elucidar o mecanismo, a clivagem proteolítica de substratos de baixo peso molecular foi testada. Esses substratos não são estabilizados por compactação de suas conformações através do mecanismo de exclusão preferido. A atividade da papaína aumentou ligeiramente, enquanto que a atividade da quimiotripsina permaneceu praticamente inalterada, sugerindo que os excipientes podem estabilizar a papaína sem reduzir a sua atividade. Estes resultados indicam que o efeito protetor dos excipientes é mediado apenas pela estabilização conformacional do AMC 85, que pode incluir maior compactação e uma possível redução na acessibilidade dos locais de clivagem das proteases. A adição de excipientes como sorbitol e glicina nos tampões durante a purificação e formulação pode, portanto, ajudar a reduzir ou até mesmo eliminar a necessidade de uso de inibidores da protease nas formulações biofarmacêuticas.
Um exemplo de como a DSC e outros métodos biofísicos podem ser usados no desenvolvimento de formulação específico de um determinado sistema de fornecimento é mostrado em um artigo de Morar-Mitrica et al. [30]. O otelixizumabe é um AMC (IgG1) humanizado direcionado contra as células CD3. Como as doses clínicas são baixas (0,1 mg a 0,5 mg por dose), o medicamento foi desenvolvido com uma concentração de 0,2 mg/mL. A administração da dose exigiu diluição do AMC em uma bolsa de IV contendo soro fisiológico, seguida da administração de todo o conteúdo via bomba de infusão. Isso levou a concentrações de proteína na bolsa de IV tão baixas quanto 0,002 mg/mL. Devido à baixa concentração de proteína, houve um alto risco de perda proteica significativa pela interação com a bolsa de IV e/ou com o sistema de bomba de infusão. Por meio de estudos de estabilidade em uso e de desenvolvimento de formulação através da biofísica convencional, um medicamento foi desenvolvido, o que reduziu as perdas por adsorção e a degradação oxidativa e a formulação líquida permaneceu estável em condições refrigeradas.
Para a seleção da formulação padrão, os valores de TM para o otelixizumabe na presença e na ausência de polissorbato 80 (PS80) a 0,1% foram determinados a partir dos termogramas de DSC. Os termogramas de proteínas na presença e ausência do PS80 foram semelhantes, com um perfil de desdobramento coerente, sugerindo que não houve nenhuma alteração de HOS em função do surfactante. Pelo menos duas espécies/domínios, correspondendo a duas transições de desdobramento, foram claramente identificados por DSC. Os resultados de DSC para o AMC na ausência e presença de PS80 não mostrou diferenças significativas em TM1 e TM2. Além disso, o PS80 não teve efeito sobre a estabilidade térmica do AMC, conforme indicado por uma comparação de outros parâmetros termodinâmicos derivados da DSC, como, por exemplo, T1/2 e entalpia total do desdobramento.
Peróxidos podem estar presentes em quantidades significativas em matérias-primas como os polissorbatos, causando possíveis danos oxidativos aos produtos biofarmacêuticos e resultando em consequências como redução da eficácia e, possivelmente, uma resposta imunogênica indesejada. Para avaliar o risco de oxidação como uma via de degradação significativa, o otelixizumabe em tampão histidina isolado (não contendo PS80) foi oxidado com peróxido de hidrogênio e as mudanças estruturais induzidas pela oxidação foram avaliadas por DSC e comparadas a um controle não oxidado. A análise de TM mostrou uma desestabilização induzida por oxidação da primeira transição de desdobramento, geralmente atribuída ao domínio CH2 do AMC. Houve uma redução significativa no TM 1 (a transição de baixa temperatura) concomitante com o alargamento do pico. A segunda transição (TM 2) não foi afetada pela oxidação. A análise por espectrometria de massa (MS) confirmou que um resíduo de metionina exposto no domínio CH2 foi 90% oxidado pelo peróxido. Estes resultados demonstram que o principal local de oxidação é o resíduo de metionina no domínio CH2 e que o evento de oxidação está correlacionado com a desestabilização termodinâmica deste domínio. Os autores concluíram que a administração de AMCs terapêuticos de baixa concentração impõe desafios e é muito importante que os estudos de desenvolvimento da formulação e de estabilidade em uso sejam realizados nas fases iniciais do desenvolvimento.
Os resultados apresentados neste documento demonstram claramente a importância e a eficácia da incorporação da DSC como estudo de estabilidade biofísica durante o desenvolvimento de pré-formulações e formulações. Usando os resultados de DSC, juntamente com outros estudos de estabilidade, as empresas de produtos biofarmacêuticos podem tomar decisões informadas sobre as formulações mais estáveis, o que significa que a proteína tem menos probabilidade de apresentar problemas de estabilidade a longo prazo e agregação em sua formulação final e como um medicamento. Isso resulta em uma produção de medicamentos mais econômica e uma maior probabilidade de que a formulação final do medicamento permaneça ativa, estável, segura e na conformação de dobramento correta.
Analytical Techniques for Biopharmaceutical Development, R. Rodriguez-Diaz, T. Wehr, S. Tuck (eds.), Taylor & Francis, New York USA (2005).
Biophysical Characterization of Proteins in Developing Biopharmaceuticals, D.J.Houde, S.A. Berkowitz (eds.), Elsevier, Amsterdam, Netherlands (2015).
Biophysical Methods for Biotherapeutics: Discovery and Development Applications, T.K. Das (ed.) John Wiley & Sons, Hoboken NJ USA (2014).
Biophysics for Therapeutic Protein Development, L.O. Nahri (ed.), Springer NewYork, USA (2013).
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal AntibodyCharacterization Volume 1. Monoclonal Antibody Therapeutics: Structure, Function, and Regulatory Space, J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Vol 1176 (2014). doi: 10.1021/bk-2014-1176.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 2. Biopharmaceutical Characterization: The NIST mAb Case Study, J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Vol 1201 (2015). doi: 10.1021/bk-2015-1201.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 3. Defining the Next Generation of Analytical and Biophysical Techniques, J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Vol 1202 (2015) DOI: 10.1021/bk-2015-1202.