Esse documento demonstra como a técnica pode ser utilizada para examinar a estabilidade de domínios individuais em proteínas de domínios múltiplos e guiar o desenvolvimento do processo de anticorpos e outras proteínas.
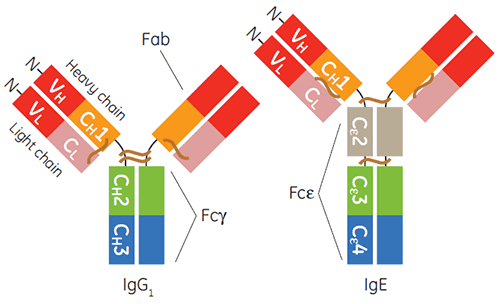
A produção e purificação de imunoglobulinas do isotipo gama, particularmente IgG1 humano, para diagnóstico ou aplicações terapêuticas é, hoje, algo quase rotineiro. Na última década, os produtos terapêuticos baseados em IgE também ganharam impulso (1-3). IgE é importante para defesa do hospedeiro contra parasitas e inflamações protetoras. Ainda assim, a sinalização mediada por IgE por meio de seus receptores também é um ponto focal de doença alérgica inflamatória (4). A região constante de IgE é um homodímero que contém pares duplicados de três domínios de desdobramento Ig únicos (Cε2, Cε3 e Cε4) e é responsável pela ligação de seus dois receptores, FcεRI e CD23, também conhecidos como FcεRII (figura 1).
O foco dessa nota de aplicação é a utilidade da calorimetria de varredura diferencial (DSC) para informar os múltiplos aspectos dos processos de desenvolvimento bioterapêuticos de IgG e IgE. A DSC permite o estudo do desdobramento proteico rapidamente e sem o uso de identificações ou sondas artificiais. A técnica determina o calor absorvido pela amostra à medida que ocorre o desdobramento proteico, fornecendo uma medida de sua termoestabilidade e uma indicação de estabilidade de longo prazo.
Especialmente no trabalho descrito aqui, é mostrado que a DSC fornece maneiras de manipular, purificar e formular fármacos de IgG e IgE. A capacidade do dicroísmo circular (CD) para contribuir com essas descobertas é contrastada ao que é possível discernir utilizando a DSC. A DSC permite a investigação da estabilidade da proteína no nível de domínios individuais em proteínas com domínios múltiplos, um aspecto menos transparente nos dados obtidos por CD.
|
Os experimentos foram realizados utilizando o MicroCal VP-Capillary DSC da Malvern.
As proteínas Fcε, Fcγ e Fcγ-Cε2 purificadas foram geradas conforme descrito previamente (5). O conjunto completo de experimentos de DSC capilar, mais de 400 varreduras a diferentes valores de pH, foi executado em um período superior a quatro meses com muito pouco esforço. Foram necessárias quase três horas de trabalho para definir os experimentos para Fcε e Fcγ, inclusive a medição de concentrações de proteína, diluições e disposição da placa. O restante do experimento foi realizado pela automatização de MicroCal VP-Capillary DSC. Os detalhes completos são descritos em (5).
A estabilidade ampla de pH/sódio é um pré-requisito para muitos processos de purificação por afinidade de proteína executados no ambiente industrial. A baixa tolerância a condições anormais de pH ou sódio pode resultar em proteínas agregadas ou não funcionais. A tolerância de Fcε a várias condições de pH/sódio é importante para determinar um esquema de purificação adequado e escalonável para proteínas com IgE/Fcε. Para estudar o efeito do pH na estrutura secundária de Fcε, foi executado CD espectral da proteína sob condições de tampão que variam de um pH 4,5 a 7,4.
Entre pH 5,2 e 7,4, o espectro de Fcε foi idêntico e continha um índice mínimo individual entre 216 e 217 nm, indicativo de folha ß significativa e típico de domínios Ig. A um pH 5, o espectro de Fcε mudou para uma direção de bobina aleatória (o nível mínimo apresentou uma mudança para 200 nm); a um pH 4,5, o espectro sugere que a proteína é predominantemente uma bobina aleatória (5). Com base no desdobramento dependente de pH, investigamos se Fcε apresenta uma estabilidade atenuada entre pH 7 e 4,5.
A desnaturação térmica de Fcε em vários valores de pH foi monitorada pelo CD far-UV. A um pH 7, houve uma transição para o desdobramento de todos os três domínios (Cε2-4). Foi observada uma transição semelhante a um pH 6, embora o Tm tenha diminuído em 1 °C. O desdobramento térmico de Fcε a um pH 5,2 resultou em uma transição muito mais ampla que iniciou 6 ºC abaixo de um pH neutro. As duas transições foram claramente evidentes somente a um pH 4,8 (5).
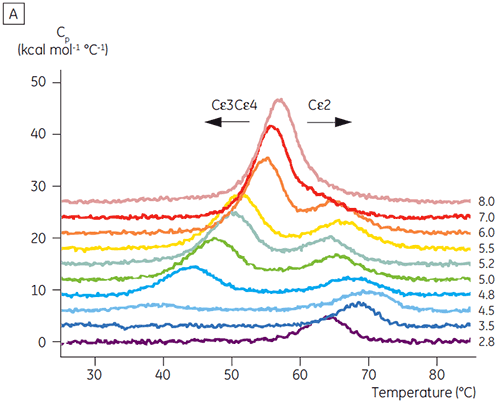
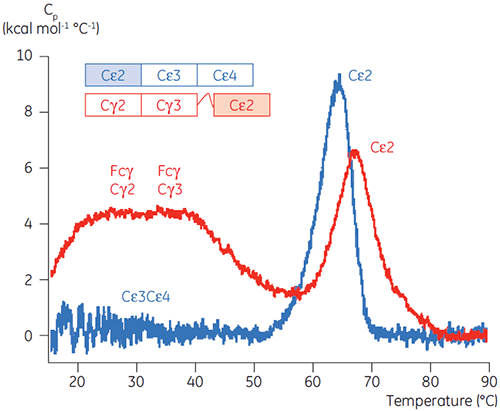
Com base nos resultados inicias de CD, os estudos detalhados de estabilidade dependentes de pH foram iniciados para Fcε e Fc utilizando DSC. As transições de desdobramento para Fcε e Fcγ se mostraram irreversíveis e dependentes da taxa de varredura (dados não mostrados), sugerindo que a agregação irreversível afeta os valores aparentes de Tm de ambas as proteínas (6,7). Ao contrário dos dados determinados por meio de CD, Fcε revelou duas transições de desdobramento independentes em todos os valores de pH abaixo de 8 (figura 2A). Uma dessas transições foi desestabilizada a um pH baixo e NaCl alto, enquanto a outra não.
|
|
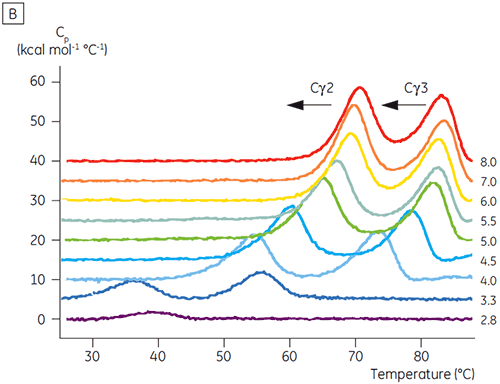
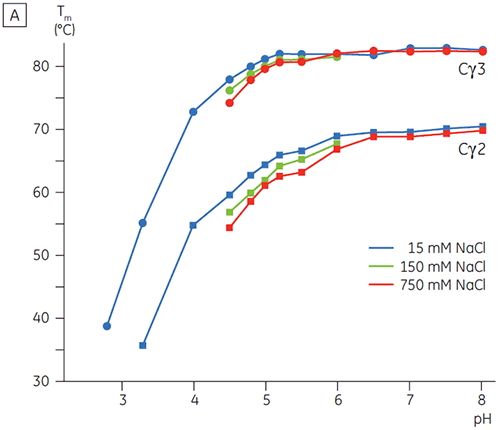
Os domínios envolvidos na transição sensível a pH foram completamente desdobrados a um pH 4,5, conforme esperado com base nos dados estruturais obtidos por meio de CD, demonstrando como a DSC pode ser importante não somente para o entendimento da estabilidade de domínios dobrados, mas também para seu status de dobramento. Fcγ (de IgG1) mostrou se desdobrar por meio de duas transições separadas; a transição de baixa temperatura pertencendo ao domínio Cγ2 e a transição de alta temperatura ao domínio Cγ3 (Figura 2B). A transição Cγ2 foi identificada por meio do efeito da deglicosilação sobre a termoestabilidade (resultados não publicados), e a transição de Cγ3 por meio de sua termoestabilidade excepcionalmente alta (8). Ambos os domínios Fcγ se mostraram sensíveis a pH e NaCl. Ao contrário de Fcε, os domínios Fcγ não foram intrinsecamente desdobrados até a redução do pH para menos de 3,0, sugerindo a razão por que os anticorpos são eluídos em um meio proteico A a valores de pH inferiores a 3,5 e por que a cromatografia de troca catiônica pode ser uma técnica de purificação adequada para IgG (figura 3).
|
|
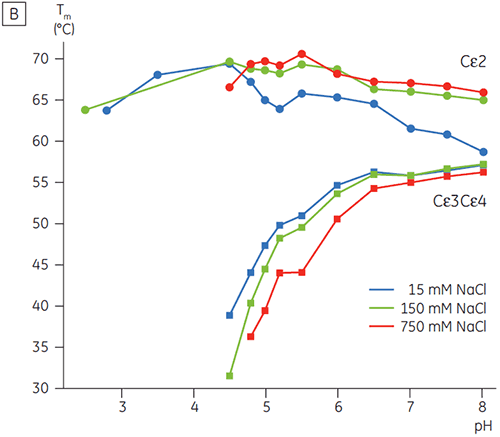
Na presença de um nível alto de sódio, os domínios Cγ2 e Cγ3 de Fcγ e os domínios Cε3 e Cε4 de Fcε foram desestabilizados. Isso foi percebido como uma pequena alteração em seus valores de Tm a 150 e 750 mM NaCl relativos a 15 mM NaCl na faixa de pH intermediária entre 5,0 e 7,0 (figura 3A). Essas pequenas diferenças de estabilidade não deverão ter um grande impacto sobre a meia-vida in vitro de Fcγ nessa faixa de pH, já que o Tm dos domínios Cγ2 e Cγ3 permaneceu acima de 60 °C.
Os domínios sensíveis a pH de Fcε foram identificados como os domínios de ligação de receptores (Cε3 e Cε4) por meio de experimentos de DSC com uma proteína de fusão de Fcγ-Cε2. Um domínio de Fcγ-Ce2 e Fcε permanece dobrado de maneira estável a um pH 2,5 (figura 4). Com base nos experimentos descritos acima, sabemos que os domínios Fcγ são intrinsecamente desdobrados abaixo de pH 3,0. Por padrão, isso identifica o domínio Cε2 de Fcε como o domínio insensível a pH. Esses resultados foram confirmados pela proteólise de Fcε a um pH 4,5 (5).
|
O domínio Cε2 de Fcε se mostrou levemente mais termoestável em concentrações maiores de sódio. Cε2 foi especialmente estabilizado a um pH neutro e 750 mM NaCl com um Tm mais de 7°C acima do Tm medida em 15 mM NaCl (figura 3B). Em comparação, NaCl desestabilizou significativamente os domínios Cε3Cε4 entre o pH 5 e 6 (figura 3B). Cε3Cε4 começaram a se desdobrar a um pH 5,0 em baixa concentração de sódio. Em concentração alta de sódio, foram transferidas 0,5 unidades de pH da transição de desdobramento para um pH 5,5, tornando desnecessário o uso de cromatografia de troca catiônica como uma etapa de purificação viável para IgE ou Fcε com proteínas.
Nesse estudo, mostramos que o Fcε demonstrou uma sensibilidade anormal a pH que resultou no desdobramento de seus domínios de ligação de receptor a um pH com 2 unidades acima do observado para Fcγ (p.ex., pH 5,0). A sensibilidade de pH/sódio de Fcε determinada pela DSC fornece informações valiosas para a escolha de estratégias de purificação, procedimentos de manuseio e formulações para proteínas baseadas em IgE e sugere que os protocolos de IgC não serão passíveis. Os dados de estabilidade de pH de Fcγ também sugerem um mecanismo provável para agregação dependente de tempo de IgG durante purificações por afinidade padrão (p.ex., mais comumente em meio proteico A) que inclui a eluição em pH baixo e etapas de contenção.
Esta nota de aplicação foi gentilmente concedida pelo Dr. Stephen Demarest, Biogen Idec, San Diego CA.
1. Zhu, D. et al. A novel human immunoglobulin Fcγ Fcε bifunctional fusion protein inhibits Fcε RI-mediated degranulation. Nature Med. 8, 518–521 (2002).
2. Zhu, D. et al. A chimeric human-cat fusion protein blocks cat-induced allergy. Nature Med. 11, 446-449 (2005).