Cette note d'application va étudier l'utilisation de la technique Nanoparticle Tracking Analysis (NTA) pour mesurer la taille et la concentration des nanoparticules utilisées pour la délivrance de médicaments tels que les liposomes, afin de déterminer l'efficacité et le taux d'absorption, la vitesse de dégradation et la vitesse d'élimination de l'organisme.
L'utilisation des nanoparticules dans la délivrance de médicaments se développe rapidement. Les nanoparticules offrent d'excellentes propriétés pharmacocinétiques, une libération contrôlée et durable, ainsi que le ciblage de cellules, tissus ou organes spécifiques. L'intérêt dans la délivrance de médicaments par les nanoparticules réside également dans le ralentissement des découvertes de nouveaux composés biologiquement actifs pouvant être exploités dans la thérapeutique. En raison de la baisse du nombre de nouveaux médicaments qui entrent sur le marché chaque année, l'utilisation des structures polyvalentes et multifonctionnelles des nanoparticules pour la délivrance de médicaments présente un intérêt croissant. Toutes ces caractéristiques peuvent améliorer l'efficacité des médicaments existants (Malam et al., 2011).
Les nanoparticules utilisées dans la délivrance de médicaments ont été définies comme des systèmes colloïdaux de taille submicronique qui peuvent être constitués d'une grande variété de matériaux dans de nombreuses compositions. Les vecteurs de nanoparticules communément définis incluent les liposomes, les micelles, les dendrimères, les nanoparticules de lipides solides, les nanoparticules métalliques, les nanoparticules semi-conductrices et les nanoparticules polymériques. Sous leurs nombreuses formes, les nanoparticules ont été intensivement utilisées pour fournir des médicaments, des gènes, des vaccins et des diagnostics dans des cellules/tissus spécifiques. (Ram et al., 2011).
Lorsque l'on prend en considération un système d'administration de médicaments par nanomatériaux, la taille de la nanoparticule est un paramètre essentiel qui influence directement les processus d'administration, d'absorption, de dégradation et d'élimination de l'organisme. Ainsi, les nanoparticules dans une plage de 30 à quelques centaines de nm de diamètre peuvent s'accumuler passivement sur le site de tumeurs en raison d'une porosité du système vasculaire. La phagocytose favorise les particules >500 nm, tandis que les clairances biliaire et rénale on lieu avec des particules <30 nm et <8 nm, respectivement. De plus, le foie présente une absorption plus lente des particules inférieures (25 et 50 nm) par rapport aux particules supérieures (200 et 300 nm). La mesure précise des particules administrées est ainsi impérative dans de nombreux processus et systèmes.
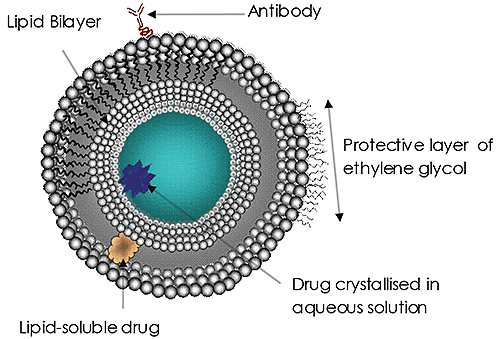
Les liposomes (Figure 1) ont fait l'objet de recherches et d'efforts de développement importants pendant de nombreuses années. Ils sont actuellement le système d'administration de médicaments ciblée le plus courant. Les liposomes ont été approuvés en tant que système d'administration d'amphotéricine B pour les infections fongiques ou à protozoaires, de doxorubicine pour le traitement du cancer du sein, et des vaccins contre l'hépatite A et la grippe. L'utilisation et le potentiel des liposomes dans l'administration de médicaments continuent de gagner en importance. Les raisons sont évidentes :
La taille des liposomes utilisés est de plus en plus reconnue comme un facteur important dans l'efficacité du traitement. La taille d'un liposome d'administration de médicaments peut affecter sa circulation et la durée de présence dans le sang, l'efficacité du ciblage, son taux d'absorption cellulaire (ou endocytose) et, enfin, l'administration réussie de sa charge utile. De telles considérations de taille sont extrêmement importantes pour tous les systèmes d'administration de médicaments à l'échelle nanométrique.
|
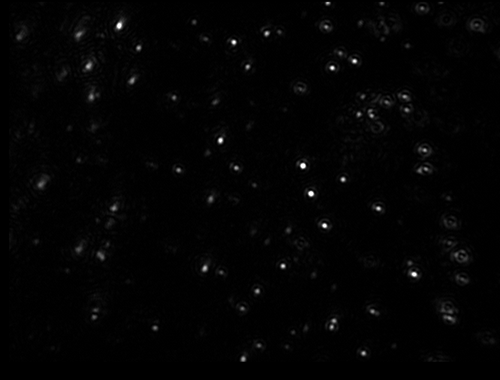
La gamme d'instruments NanoSight de Malvern mesure et compte rapidement et avec précision les liposomes dans l'eau et d'autres solvants. Seuls de petits volumes sont requis et la préparation des échantillons est réduite au minimum. Les instruments permettent de visualiser des liposomes individuels en suspension et de suivre leur mouvement brownien, ce qui permet d'établir les répartitions granulométriques, d'après des particules individuelles, en quelques secondes seulement.
|
Outre la taille et la concentration, la technique NTA fournit également les paramètres suivants, en simultané et particule par particule :
Les poly(β-amino ester)s (PBAE) sont des systèmes d'administration potentiels pour les thérapies géniques visant à traiter différents cancers. Leur avantage par rapport à d'autres systèmes est que de nombreuses associations de polymères avec l'ADN peuvent être effectuées par la voie combinatoire. Ils possèdent également des propriétés de libération rapide grâce à la dégradation hydrolytique, ce qui entraîne toutefois des problèmes de dosage, de production et de stockage. La lyophilisation est une méthode de stockage typique et la technique NTA a été utilisée pour évaluer l'effet de la lyophilisation sur l'agrégation (augmentation de taille) et la destruction (diminution de taille) des nanoparticules PBAE-ADN (Tzeng et al. 2011 and Sunshine et al. 2012).
Le poly(acide lactique-co-acide glycolique) (PLGA) est un système d'administration de médicaments approuvé par la FDA. Il se sépare en acide lactique et acide glycolique, tous deux points d'extrémité de chemins métaboliques dans l'organisme. Le PLGA est utilisé en tant que système d'administration de l'amoxicilline, mais aussi de l'hormone de libération des gonadotrophines pour le traitement du cancer de la prostate de stade avancé. L'acide mycophénolique immunosuppresseur a été intégré dans le PLGA afin de diminuer les dosages, et ainsi réduire les effets secondaires toxiques. La technique NTA a été utilisée pour déterminer la taille de ces nanoparticules, un paramètre essentiel pour assurer une bonne administration et permettre aux chercheurs de comparer les résultats entre les études (Shirali et al. 2011).
Le transport réussi des molécules dans la membrane cellulaire est un point essentiel de leur administration. Dans de nombreux cas, les molécules seules ne peuvent pas pénétrer la membrane cellulaire, un vecteur efficace est donc nécessaire. Sokolova et al. (2012) se sont penchés sur les nanoparticules de phosphate de calcium (diamètre : 100 nm - 250 nm, selon la fonctionnalisation) en tant que vecteurs polyvalents pour les petites et grandes molécules entre les membranes cellulaires à l'aide de différentes techniques incluant les techniques NTA, DLS (Dynamic Light Scattering, diffusion dynamique de la lumière) et EM (Electron Microscopy, microscopie électronique).
Ohlsson et al. (2012) ont présenté un rapport sur le transport de soluté dans une échelle de temps inférieure à 100 millisecondes sur la membrane lipidique à deux couches de protéoliposomes individuels, et ont utilisé la technique NTA pour vérifier la stabilité et l'intégrité des liposomes.
Dans les recherches sur les nanoparticules en tant que vecteurs génétiques, Ghonaim et ses collègues ont largement fait état de l'utilisation de la technique NTA dans leur travail sur l'effet des modifications de la chimie des lipopolyamines et spermines dans différents systèmes d'administration de pARNi et d'ADN plasmidique non viral (Ghonaim et al., 2007a; Ghonaim et al., 2007b; Ghonaim et al., 2007c; Ghonaim, 2008; Ghonaim et al., 2009; Soltan et al., 2009; Ghonaim et al., 2010). De même, Ofek et al. (2010) ont employé la technique NTA pour la caractérisation des nanovecteurs dendritiques pour l'administration de pARNi, tandis que Bhise a mesuré la taille des particules et leur répartition granulométrique grâce à la méthode NTA dans son étude des polymères d'administration de gènes dans la culture cellulaire (Bhise et al., 2010). Récemment, Bhise a poussé ces recherches pour mettre au point un essai permettant de quantifier le nombre de plasmides encapsulés par des nanoparticules polymères. Il a utilisé la technique NTA pour déterminer le nombre volumique de plasmides par nanoparticule de 100 nm (Bhise et al., 2011)
Wei et al. (2012), en explorant les difficultés et les perspectives des progrès dans les nanomédicaments, ont souligné la nécessité de disposer de méthodes fiables pour la caractérisation précise de la taille, de la forme et de la composition des nanoparticules, ainsi que l'assemblage des nanoparticules pour maintenir des niveaux faibles de cytotoxicité non spécifique et augmenter la stabilité pendant le stockage.
D'autres exemples de l'importance de la mesure et du dénombrement des systèmes d'administration de médicaments par nanoparticule via la technique NTA ont été signalés (Hsu et al., 2010; Park et al., 2010; Tagalakis et al., 2010).
1. Bhise NS, Gray RS, Sunshine JC, Htet S, Ewald AJ and Green JJ (2010) The relationship between terminal functionalization and molecular weight of a gene delivery polymer and transfection efficacy in mammary epithelial 2-D cultures and 3-D organotypic cultures, Biomaterials, doi:10.1016/j.biomaterials.2010.07.023
2. Bhise NS, Shmueli RB, Gonzalez J and Green JJ (2011), A Novel Assay for Quantifying the Number of Plasmids Encapsulated by Polymer Nanoparticles. Small. doi: 10,1002/smll.201101718
3. Ghonaim HM, (2008) Design and Development of Pharmaceutical Dosage Forms for Gene and siRNA Delivery, Thèse de doctorat, Université de Bath, Department of Pharmacy and Pharmacology, septembre 2008
4. Ghonaim HM, Li S and Blagbrough IS (2010) N1,N12-Diacyl Spermines: SAR Studies on Non-viral Lipopolyamine Vectors for Plasmid DNA and siRNA Formulation Pharmaceutical Research, Vol. 27, (1) p. 17-29
5. Ghonaim HM, Li S, Soltan MK, Pourzand C and Blagbrough IS (2007a), Chain Length Modulation in Symmetrical Lipopolyamines and the effect on Nanoparticle Formulations for Gene Delivery, in British Pharmaceutical Conference BPC2007, Manchester, 10 sept.
6. Ghonaim HM, Li S, Pourzand C and Blagbrough IS (2007b), Efficient Novel Unsymmetrical Lipopolyamine Formulations for Gene Delivery, in British Pharmaceutical Conference BPC2007, Manchester, 10 sept.
7. Ghonaim H M, Li S, Pourzand C and Blagbrough IS (2007c), Formulation and Delivery of Fluorescent siRNA by Lipospermine Nanoparticle Complex Formation, in British Pharmaceutical Conference BPC2007, Manchester, 10 sept.
8. Ghonaim H, Li S and Blagbrough IS (2009) Very Long Chain N4 , N9 -Diacyl Spermines: Non-Viral Lipopolyamine Vectors for Efficient Plasmid DNA and siRNA Delivery Pharmaceutical Research, Volume 26, numéro 1, p. 19-31
9. Hsu J, Serrano D, Bhowmick T, Kumar K, Shen Y, Kuo Y C, Garnacho C and Muro S (2010) Enhanced Endothelial Delivery and Biochemical Effects of α-Galactosidase by ICAM-1-Targeted Nanocarriers for Fabry Disease Journal of Controlled Release, Article dans la presse, doi:10,1016/j.jconrel.2010,10.031
10. Malam Y, Lim E and Seifalian A (2011) Current trnds in application of nanoparticles in drug delivery, Current Medicinal Chemistry, Volume 18, numéro 7, mars 2011, p. 1 067-1 078 (12)
11. Ofek P, Fischer W, Calderon M, Haag R and Satchi-Fainaro R (2010) In vivo delivery of small interfering RNA to tumors and their vasculature by novel dendritic nanocarriers. FASEB J..doi 10:1096/fj.09-14964
12. Ohlsson G, Tabaei S, Beech JP, Kvassman J, Johansson U, Kjellbom P , Tegenfeldt JO and Höök F(2012) Solute transport on the sub 100 ms scale across the lipid bilayer membrane of individual proteoliposomes, Lab Chip, 2012, Accepted Manuscript, DOI: 10,1039/C2LC40518K
13. Park J, Gao W, Whiston R, Strom T, Metcalfe S and Fahmy TM (2010) Modulation of CD4+ T Lymphocyte Lineage Outcomes with Targeted, Nanoparticle-Mediated Cytokine Delivery, Mol. Pharmaceutics, 2011, 8 (1), p. 143-152
14. Ram M, Yaduvanshi KS, Yadav H, Singh N, Mangla G, Shivakumar H (2011) Nanoparticles, Promising Carriers in Drug Targeting: A review current drug therapy, Volume 6, numéro 2, mai 2011, p. 87-96(10)
15. Reshetov et al, Photochem Photobiol. 2012 Sep-Oct;88(5):1256-64. doi: 10,1111/j.1751-1097,2012.01176.x
16. Shirali, et al. Am J Transplantation. 2011; 11: 2582-2592
17. Sokolova V, Rotan O, Klesing J, Nalbant P, Buer J, Knuschke T, Westendorf AM and Epple M (2012) Calcium phosphate nanoparticles as versatile carrier for small and large molecules across cell membranes, Journal of Nanoparticle Research, Volume 14, numéro 6 (2012), 910, DOI: 10,1007/s11051-012-0910-9
18. Soltan MK, Ghonaim HM, El Sadek M, Kull MA, El-aziz LA and Blagbrough IS (2009) Design and Synthesis of N4, N9-Disubstituted Spermines for Non-viral siRNA Delivery - Structure-Activity Relationship Studies of siFection Efficiency Versus Toxicity, Pharmaceutical Research, Volume 26, numéro 2, p. 286-295
19. Sunshine et al. PLoS ONE, 2012; 7(5):e37543. doi:10,1371 /journal. Pone .0037543
20. Tagalakis A D, Grosse S M, Meng Q-H, Mustapa M F M, Kwok A, Salehi S E, Tabor A B, Hailes H C and Hart S L (2010) Integrin-targeted nanocomplexes for tumour specific delivery and therapy by systemic administration, Biomaterials, Vol. 32, Édition 5, février 2011, p.1 370-1 376
21. Tzeng et al. Biomaterials. août 2011 ; 32(23): 5402-5410. doi:10,1016/j.biomaterials.2011,04.016
22. Wei A, Mehtala JG and Patri AK (2012) Challenges and opportunities in the advancement of nanomedicines, Journal of Controlled Release, http://dx.doi.org /10,1016/j.jconrel.2012,10.007