Les travaux présentés ici illustrent l'utilisation de la calorimétrie différentielle à balayage (DSC) dans les premières étapes de la caractérisation des protéines, pour obtenir rapidement les données critiques relatives à la stabilité des protéines ; ces données pouvant être utilisées pour orienter et accélérer le développement de formulations liquides.
Il existe des projets de développement d'anticorps monoclonaux pour une grande variété d'indications cliniques (1, 2). Pour pouvoir en réussir le développement et en faire des substances biopharmaceutiques efficaces, les protéines recombinantes d'intérêt commercial, dont des anticorps monoclonaux, doivent être caractérisées au-delà de leur activité biologique. En particulier, elles doivent résister aux dégradations chimiques et être physiquement stables dans un environnement donné, sans avoir tendance à s'agréger (3, 4). De plus, elles nécessitent une demi-vie sérique favorable et ne doivent pas présenter de potentiel immunogène (5).
En plus d'être plus cher à produire que les formulations liquides, les produits médicamenteux lyophilisés (DP) doivent être reconstitués par le médecin, ce qui peut prendre 10 à 20 minutes avant l'administration parentérale au patient. La simplification de l'administration est le principal moteur qui pousse l'industrie biopharmaceutique à concentrer ses ressources sur le développement de formulations liquides plutôt que sur les produits médicamenteux lyophilisés. Certains problèmes techniques associés aux formulations liquides doivent néanmoins être résolus. Le principal défi est de maintenir la stabilité de la protéine biopharmaceutique dans une formulation liquide, en maximisant la stabilité physique et en minimisant la dégradation chimique. Il est particulièrement difficile de développer des substances biopharmaceutiques pour administration sous-cutanée car, pour compenser les limitations imposées par le volume injectable, de 1,0 à 1,5 ml (6), la concentration de la protéine dans la formulation liquide doit être aussi élevée que possible.
|
Ceci exerce une pression énorme sur les équipes chargées du développement, pour qu'elles fournissent des formulations liquides parfaitement ajustées, adaptées de façon optimale à chaque substance biopharmaceutique. L'analyse de la structure et de la stabilité des protéines recombinantes, en particulier des anticorps monoclonaux, est d'une importance considérable et constitue un préalable indispensable au développement de formulations de substances biopharmaceutiques. Plusieurs techniques permettent aujourd'hui d'obtenir des informations sur la structure et la stabilité des protéines. La DSC s'est imposée comme l'une des principales techniques physico-chimiques permettant d'étudier la stabilité des protéines biopharmaceutiques (7-11). Celle-ci permet l'étude rapide de la dénaturation des protéines sans marquage ni utilisation de sondes artificielles. Cette technique détermine la chaleur absorbée par l'échantillon lorsque la protéine se déplie, et donne une mesure de sa stabilité thermique et une indication de sa stabilité à long terme.
Des programmes de développement de formulations liquides spécifiques ont été mis en place pour fournir efficacement des formulations liquides optimisées de substances biopharmaceutiques. La figure 1 présente un schéma général typique du processus de développement d'une formulation liquide.
La DSC a montré son potentiel dans les phases initiales du développement de formulations liquides, un stade auquel il est préférable de réduire rapidement le nombre de formulations à étudier pour réaliser des économies tant en principe actif, qu'en temps passé en travaux analytiques complexes.
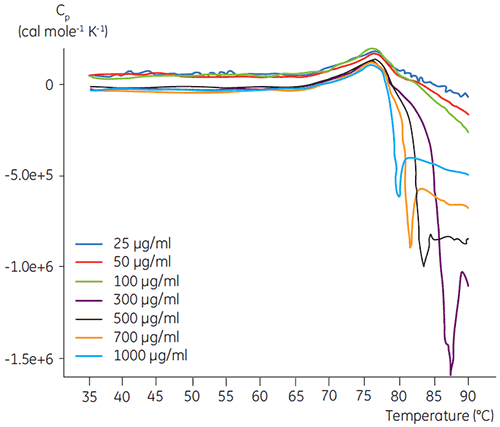
Des expériences de DSC ont été réalisées à l'aide du MicroCal VP-DSC de Malvern (Malvern Instruments) avec un balayage à 1,5 K/min. Les échantillons ont été dégazés pendant cinq minutes avant l'analyse. Dans toutes les expériences, la cellule de référence du calorimètre a été remplie d'un tampon correspondant au tampon de l'échantillon. La ligne de base du tampon a été soustraite des courbes des protéines et la capacité calorifique molaire a été utilisée pour l'analyse des données. L'irréversibilité de la dénaturation induite par la température de chaque protéine, a été vérifiée en comparant les courbes de DSC obtenues au chauffage et au réchauffage (données non présentées). Aucune réversibilité n'a été observée. Les températures de dénaturation ont été obtenues par analyse des profils calorimétriques selon un modèle de transition à deux états. Le rapport signal sur bruit optimal a été obtenu pour une concentration d'anticorps de 100 µg/ml (figure 2). Bien que des concentrations supérieures n'aient eu aucun impact sur la température de dénaturation, celles-ci induisaient un fort dégagement exothermique du fait de l'agrégation des protéines après la dénaturation.
|
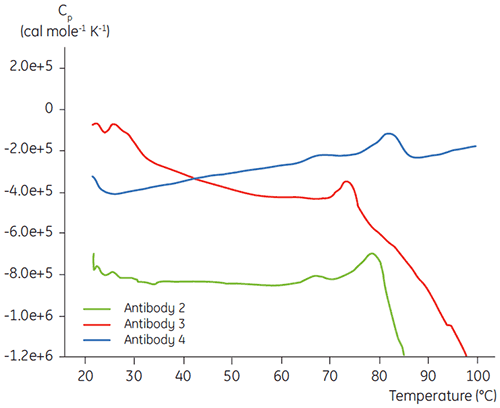
Lors de la phase initiale de caractérisation d'une protéine dans un programme de développement d'une formulation liquide d'un anticorps donné, la DSC est utilisée pour comparer la stabilité globale par rapport à d'autres anticorps en cours de développement. Comme cela est visible sur la figure 3, de grandes différences peuvent être observées entre les températures de dénaturation de différents anticorps.
|
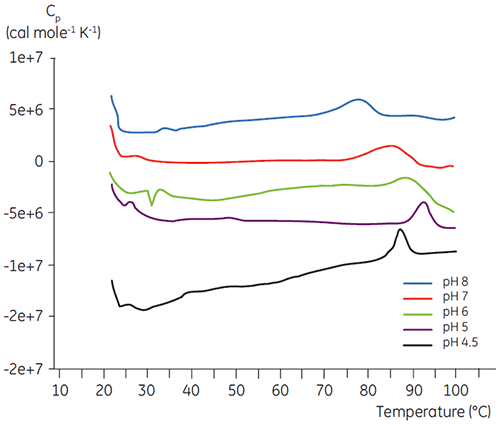
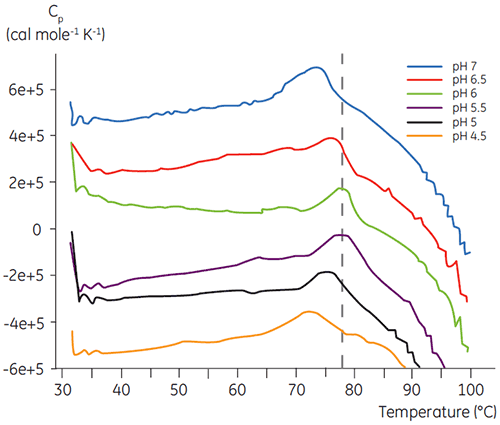
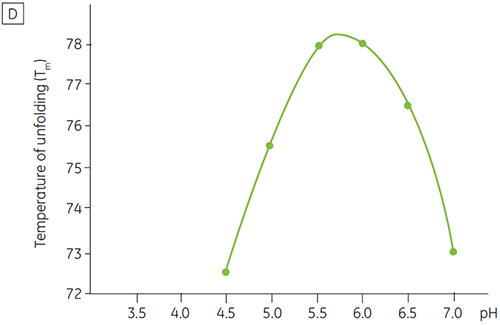
Comme la plupart des protéines, les substances biopharmaceutiques sont très sensibles au pH et il est indispensable de trouver le pH optimal pour maximiser la stabilité. La DSC s'est avérée être un outil efficace pour l'optimisation du pH car elle permet d'obtenir des informations sans avoir à réaliser des études de stabilité accélérées sur deux et quatre semaines. Bien que pour la plupart des anticorps, la stabilité optimale se situe entre pH 5,5 et 6, des déviations ont été constatées et il est donc important de caractériser ce pH optimal. Les figures 4 et 5 présentent les profils de pH d'une protéine de fusion et de l'anticorps 2. Comme on peut le voir, le pH optimal de la protéine de fusion (figure 4) était de 5 pour une Tm de 92,8 °C. La protéine de fusion a été progressivement déstabilisée à des valeurs de pH supérieures à 5 mais était particulièrement sensible aux faibles valeurs de pH. Aucune dénaturation n'a pu être observée à pH 4 (données non représentées). La figure 5 montre un profil de pH typique d'un anticorps. La meilleure stabilité a été obtenue à pH 5,5 et pH 6, pour une valeur de Tm de 78,5 °C.
|
|
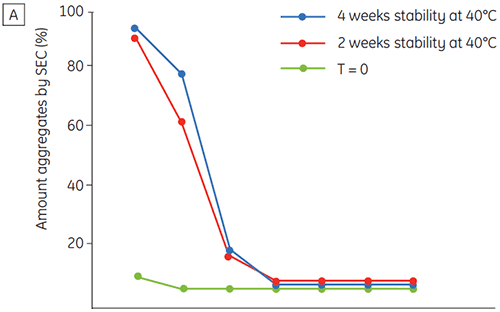
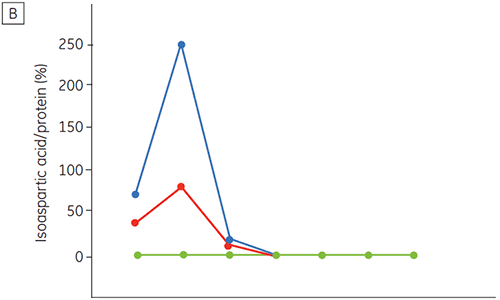
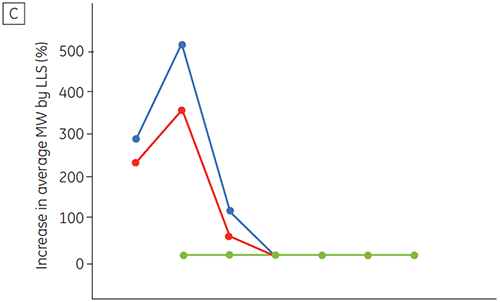
La figure 6 présente les données de stabilité chimique et physique de l'anticorps 2 en fonction du temps et du pH (phase de caractérisation initiale de la protéine). L'étude du profil de stabilité au pH montre qu'après incubation de l'anticorps 2 pendant deux et quatre semaines à ≤ pH 5 et à 40 °C, des changements importants de la stabilité surviennent. La DSC a permis d'identifier les conditions de pH optimales de cet anticorps monoclonal en utilisant uniquement les échantillons fraîchement préparés (temps zéro), en donnant des résultats similaires à ceux des autres méthodes (figure 5). De plus, la DSC a identifié les valeurs ≥ pH 6,5 comme provoquant une déstabilisation, un point qui n'apparaissait pas de façon évidente à l'issue des études sur deux et quatre semaines, mais qui aurait nécessité des études de stabilité étalées sur huit à douze semaines. En d'autres termes, les résultats de DSC corrèlent très bien avec les autres méthodes utilisées dans cette étude pour optimiser le pH du tampon de la formulation.
|
|
|
|
La DSC a pour avantage qu'elle nécessite uniquement l'analyse des échantillons au temps zéro pour obtenir une indication de la stabilité. Ceci est possible car le chauffage des protéines induit en lui-même un stress. De manière générale, si la conformation native d'une protéine est stabilisée, celle-ci résiste mieux à un stress thermique supérieur (dénaturation à une température supérieure) par rapport à une protéine déstabilisée. Par conséquent, grâce à l'utilisation de la DSC, il n'a pas été nécessaire de tester la stabilité des échantillons sur le long terme à différentes températures, pour obtenir simplement des informations sur l'impact d'une formulation liquide particulière sur la stabilité de la protéine.
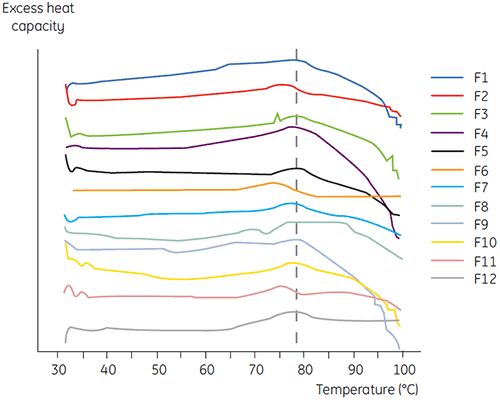
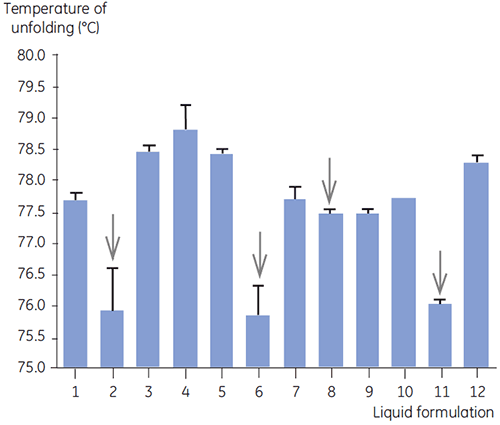
La DSC a été utilisée pour le criblage primaire de l'anticorps 2 en même temps que d'autres méthodes biophysiques, dont la SEC, la diffusion de lumière laser (LLS), l'électrophorèse capillaire (CE), et la SDS-PAGE, pour sélectionner les formulations liquides les plus prometteuses. Les échantillons ont été soumis à une étude de stabilité accélérée et ont été analysés après quatre semaines. La DSC s'est avérée particulièrement efficace pour l'identification des formulations ayant un impact négatif sur l'anticorps 2, mais la technique a également permis d'identifier les formulations liquides favorables. L'analyse des échantillons par DSC au temps zéro a permis d'identifier les quatre formulations liquides (formulations 2, 6, 8 et 11) lors du criblage primaire, qui avaient été jugées non satisfaisantes selon les autres techniques analytiques. La figure 7 montre les thermogrammes et la figure 8 donne les températures de dénaturation (Tm) de l'anticorps 2 dans les formulations liquides F1 à F12, suite au criblage primaire. Dans la formulation F9, la dénaturation de l'anticorps 2 est caractérisée par un motif présentant une forte déviation. Pour cette raison, celle-ci a été considérée comme une formulation critique.
|
|
La DSC est une technologie qui peut apporter beaucoup dans les phases initiales de la caractérisation des protéines et du développement de formulations. Elle permet d'obtenir rapidement des données critiques sur la stabilité des protéines et peut être utilisée comme guide pour assister et accélérer les projets de développement de formulations liquides.
Cette note d'application a été établie par le Dr Fredrik Ollila, Novartis Pharma AG.