La stabilité d’une protéine thérapeutique candidate est déterminante pour la réussite ou l'échec de son développement. La stabilité d’une protéine a une incidence sur sa production, sa fabrication, sa formulation, sa conservation à long terme, son administration au patient et son efficacité. Les protéines extrêmement stables ont tendance à connaître moins de problèmes pendant la fabrication, elles sont plus rentables à produire et garantissent un maintien de leur propriétés fonctionnelles pendant la formulation et la conservation. La définition de la qualité par la conception (ou « QbD, Quality by Design ») est une approche du développement de produits biopharmaceutiques dont la caractérisation de la stabilité constitue la première évaluation du potentiel de développement et des propriétés pharmaceutiques d’une molécule candidate. La stabilité de la molécule est systématiquement contrôlée pendant la phase de développement et de fabrication. Les données relatives à la stabilité sont prises en compte pour déterminer la structure d’ordre supérieur et la cartographie peptidique utilisées à des fins de fabrication, de comparabilité biopharmaceutique et de biosimilarité. Le fait de déterminer la structure d’ordre supérieur d’une protéine est devenu une pratique courante lorsqu’il s’agit de soumettre une demande d’approbation réglementaire de médicaments biopharmaceutiques et biosimilaires.
Compte tenu de la nature complexe des protéines, les instruments capables de déterminer les propriétés biophysiques jouent un rôle important dans l’analyse d’un produit biopharmaceutique. Il existe divers instruments biophysiques généralement utilisés pour évaluer la stabilité d’une protéine, notamment (mais non exclusivement) le dichroïsme circulaire (DC), la diffusion dynamique et statique de la lumière (DLS et SLS), la chromatographie d’exclusion stérique (filtration sur gel) couplée avec la mesure de la diffusion de la lumière multi-angle (SEC-MALS), la spectroscopie infrarouge à transformée de Fourier (FTIR), l'ultrafiltration à flux tangentiel, la chromatographie d’exclusion stérique (SEC), fluorimétrie différentielle à balayage (DSF), la fluorescence intrinsèque (IF) et la calorimétrie différentielle à balayage (DSC).
Même si toutes ces techniques jouent un rôle important dans le développement des produits biopharmaceutiques, il est indispensable d'utiliser la DSC pour déterminer la stabilité thermique. Dans un article datant de 2015 portant sur les techniques biophysiques utilisées pour déterminer la structure d’ordre supérieur d’anticorps monoclonaux, Gokarn et al. ont déclaré : « La DSC reste une technique incomparable pour évaluer la stabilité thermodynamique des protéines dans une solution tampon donnée »[1].
Cet article porte principalement sur l'utilisation de la DSC pour déterminer la stabilité thermique de substances biopharmaceutiques de type protéique (essentiellement les anticorps) pendant la phase de développement de pré-formulation et de formulation afin de choisir la solution adéquate où la protéine est de préférence sous sa forme d’origine adoptant une conformation repliée pour produire un médicament stable et efficace.
La DSC est une technique de microcalorimétrie utilisée pour déterminer la stabilité thermique et conformationnelle des protéines, des acides nucléiques, des lipides et d’autres biopolymères. La DSC mesure la capacité calorifique en fonction de la température. Les instruments de DSC utilisés pour caractériser une protéine et décrits dans cet article sont des instruments de « compensation de puissance » avec une cellule d’échantillonnage contenant le polymère de la solution tampon et une cellule d'étalonnage correspondante contenant la même solution tampon. La capacité calorifique (Cp) de la cellule d'échantillonnage est comparée à celle d’étalonnage. Au fur et à mesure que la température augmente, les différences de température relevées entre les cellules d’étalonnage et d'échantillonnage sont systématiquement mesurées et calibrées selon des unités de puissance. La DSC est un « essai de dégradation accélérée » puisque lorsque la protéine est exposée à des températures croissantes elle se dénature, et la capacité calorifique augmente proportionnellement (Figure 1).
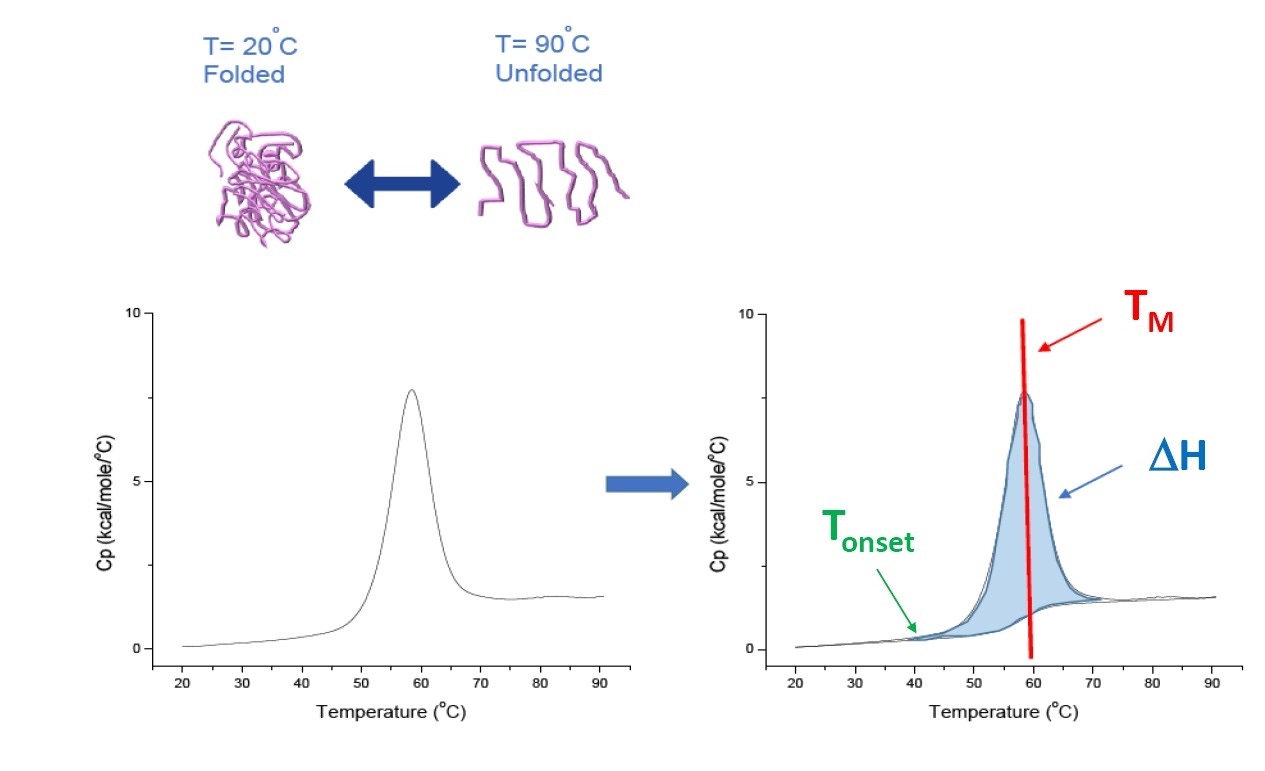
Figure 1: Comprendre le fonctionnement de la DSC : la capacité calorifique (Cp) change lorsque la protéine est dénaturée sous l’effet de la chaleur. Le test DSC débute à une température où la protéine est essentiellement à l’état natif (protéine repliée). Lorsque la température s’élève la protéine est dénaturée, elle se dénature à certain endroit (Tonset) et la capacité calorifique Cp augmente. La capacité calorifique Cp atteindra sa valeur maximale à une température indiquant un équilibre entre état dénaturé et état natif de la protéine, définit par le point médian de transition thermique TM. Pour des valeurs supérieures à ce point TM, la protéine sera principalement dénaturée et c’est au terme du test DSC que l’on observera une dénaturation complète de l’ensemble de la protéine. Parmi les paramètres expérimentaux s’appliquant à la DSC, on retrouve le Tonset, le TM et l’enthalpie de dénaturation (ΔH).
La DSC mesure directement la variation calorifique sans avoir recours à des agents fluorescents et à tout autre sonde ou marqueur. Pour une protéine qui subit une dénaturation réversible, le point médian de transition thermique (TM) également appelé température de fusion ou de dénaturation correspond à la température où la protéine est à son état d’équilibre conformationnel (équilibre entre état natif et dénaturé). Le pic observé sur un thermogramme DSC correspond au point TM.
Le point TM est un bon indicateur de stabilité thermique. Plus ce point est élevé, plus la protéine est stable d’un point de vue thermique. En général, sur un thermogramme DSC plusieurs pics apparaissent avec des protéines multidomaines telles que les anticorps. Par conséquent, il est possible d’identifier différents points TM (voir Figure 2).
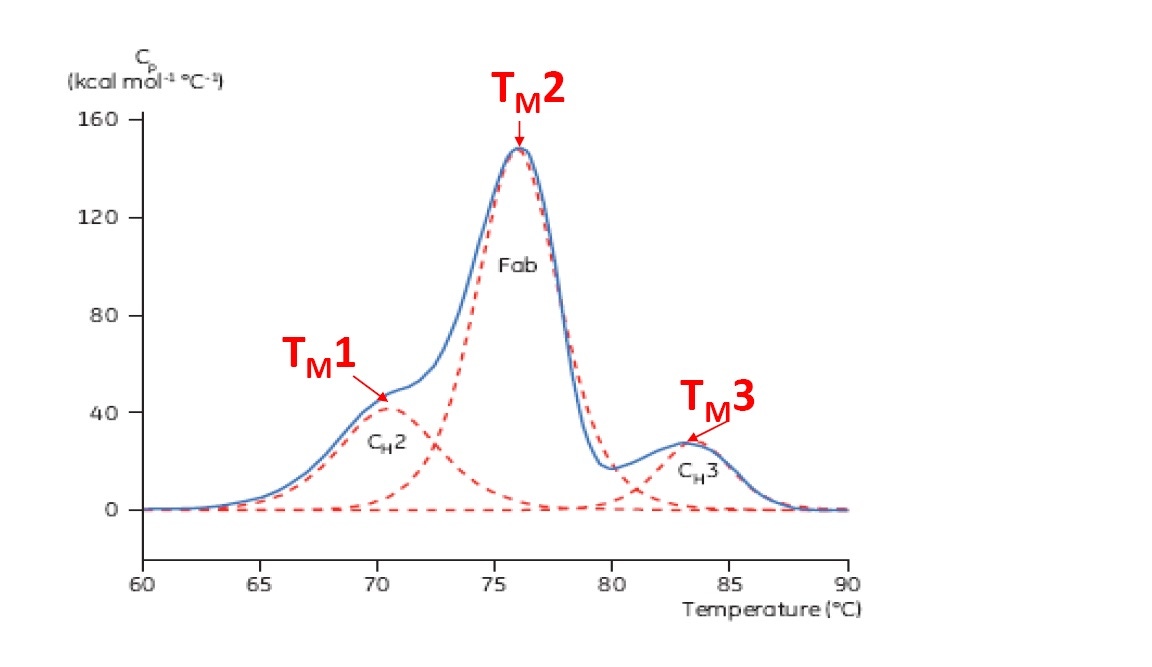
Figure 2: Thermogramme DSC représentatif d’un anticorps monoclonal constitué d’un fragment CH2, CH3 et Fab. Les lignes rouges en pointillées correspondent aux déconvolutions de pics pour chaque transition de fragments. On observe ainsi les trois points TM.
La DSC fournit d’autres paramètres importants pouvant être utilisés pour caractériser et définir la stabilité protéique, notamment l’enthalpie de dénaturation (ΔH) qui correspond à la surface sous la courbe. La dénaturation de la protéine est un processus endothermique puisque la production d’énergie est nécessaire pour rompre les liaisons secondaires non-covalentes et pour maintenir la protéine repliée. La DSC détermine également le point Tonset (début de la dénaturation), le point ΔCp (variation de la capacité calorifique associée à la dénaturation) et le point T1/2 (largeur à mi-hauteur du pic, révélateur de la forme du thermogramme représentatif de la dénaturation). L’analyse par DSC permet de définir plusieurs ensembles de paramètres.
La plupart des protéines dénaturées de manière irréversible ont tendance à s’agglomérer ou à se cristalliser sous l’effet de la chaleur. Le point TM ainsi que les autres paramètres provenant de l’analyse de protéines dénaturées de manière irréversibles réalisée par DSC ne sont pas de vrais paramètres thermodynamiques. Cependant, le classement par ordre de grandeur des valeurs TM établi à partir de l’analyse de protéines dénaturées de manière irréversible réalisée par DSC est un précieux paramètre qualitatif du test de stabilité.
Malvern Instruments offre le système DSC MicroCal VP-Capillary qui est un calorimètre différentiel à balayage conçu pour analyser la TM et permettre la caractérisation thermodynamique de protéines et de biopolymères en solution.
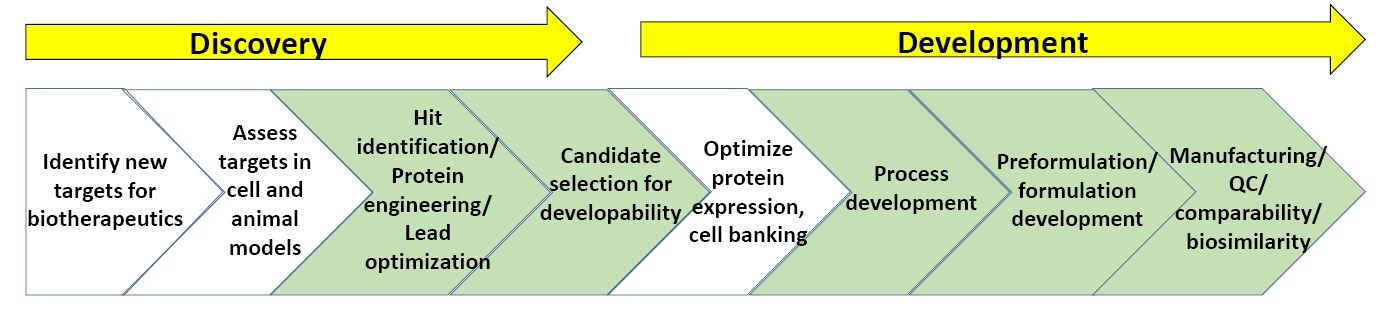
Figure 3. Système de procédés dans la recherche et le développement de composé biopharmaceutiques.
La figure 3 révèle un système généralisé dans la recherche et le développement de composé biopharmaceutiques. Les parties vertes mettent en évidence les points pour lesquels la caractérisation biophysique, notamment les tests de stabilité, sont les plus couramment utilisés (à la fin de cette article, une liste de lecture sur la recherche et le développement de procédés biopharmaceutiques vous est proposée).
La séquence d’acides aminés qui génère une chaîne polypeptidique est qualifiée de structure primaire de la protéine. De plus, il existe 3 différents niveaux de structure d’ordre supérieur qu’il est important de connaître pour comprendre parfaitement ce qu’est la stabilité, la fonctionnalité, l’activité et la nature même de la protéine. La structure secondaire de la protéine décrit le repliement local de la structure primaire de la protéine, notamment l'hélice α et le feuillet β, la structure tertiaire correspond à la structure tridimensionnelle d’une protéine, provenant d’un ensemble d'éléments de la structure secondaire, et la structure quaternaire regroupe l’association d’au moins deux chaînes polypeptidiques identiques ou différentes.
L’administration se fait le plus fréquemment par voie sous-cutanée (SC). Les protéines médicamenteuses administrées par voie sous-cutanée doivent être stables et résistantes à des concentrations très élevées en protéine (plus de 100 mg/ml), que ce soit dans un flacon ou une seringue pré-remplie, et cela pendant plusieurs années. En tenant compte de cela et pour créer des produits biopharmaceutisues bénéfiques, les scientifiques cherchent d’abord des molécules présentant une stabilité élevée. Cependant, dans le cadre de procédés de développement et de fabrication, il existe plusieurs facteurs qui peuvent nuire à la stabilité de la molécule, ce qui signifie qu’une stabilité accrue peut être apportée par ingénierie des protéines.
La purification des protéines est un processus destiné à isoler la protéine d’un milieu dans lequel elle est stable, correctement pliée et active. Il est donc primordial de modifier avec précaution les solutions tampon, les additifs, les techniques de purification et les conditions de conservation afin de maintenir une protéine aussi stable que possible à ce stade. Lorsque les molécules de protéines sont exposées à des facteurs de contrainte fréquemment présents lors de la formulation et de la production de procédés biopharmaceutiques comme la chaleur, les produits chimiques, les variations de pH et la pression, cela peut conduire à la dénaturation de la protéine.
Les protéines en solution risquent également de subir des modifications telles que la désamidation et l’oxydation pouvant donner lieu à des protéines inactives et dénaturées. Dans le cas de procédés biopharmaceutiques protéiniques, la dénaturation ou d’autres modifications pourraient entraîner la formation d'agrégats susceptibles de réduire son efficacité ou de lui conférer des propriétés non-fonctionnelles. Il est peut-être encore plus important de souligner que l'agrégation de protéine peut provoquer des réponses indésirables et immunogènes potentiellement mortelles chez certains patients. L’utilisation de protéines intrinsèquement stables permet de fabriquer des produits médicamenteux efficaces, bénéfiques et sans danger, de manière plus avantageuse en termes de coûts.
La DSC offre un aperçu détaillé de la stabilité conformationnelle et des modifications de la structure tertiaire et quaternaire qui surviennent lorsqu’une protéine est dénaturée sous l’effet de la chaleur mais elle fournit également des informations sur la manière dont les facteurs intrinsèques et extrinsèques peuvent modifier la stabilité protéique. La DSC est considérée comme la meilleure et la plus performante méthode d’analyse quantitative pour déterminer la stabilité thermique de protéines biopharmaceutiques. De plus, elle est utilisée comme un bon indicateur de stabilité à long terme[1,10-14]. La DSC permet de générer des valeurs TM qui constituent un paramètre fréquemment utilisé pour classer par ordre de grandeur la stabilité lors du processus de sélection du produit candidat (développabilité), lors de l’analyse de la formulation et lors du développement de procédés. L’enthalpie (ΔH), les valeurs Tonset, T1/2 et ΔCp mesurées par DSC sont aussi utilisées pour enregistrer de manière ordonnée la stabilité, pour valider les données de DSC, l’analyse quantitative de la protéine dénaturée et la « cartographie peptidique » de la structure d’ordre supérieur[10-14].
L’analyse réalisée par DSC de protéines hautement similaires et présentes en solution dans des conditions définies est une analyse quantitative qui peut être reproduite (Figure 4). En d’autres termes, les thermogrammes DSC présenteront un profil similaire et les paramètres (notamment les valeurs TM, ΔH et Tonset) seront jugés acceptables [12-14]. Si l’on observe des thermogrammes et des paramètres de DSC différents, cela semblera indiquer qu’il y a eu par exemple un repliement anormal de protéines, des écarts observés dans la solution tampon, des changements dans la modification post-translationnelle ou d’autres modifications de la structure d'ordre supérieur, ayant tous une incidence négative sur la stabilité conformationnelle de la protéine.
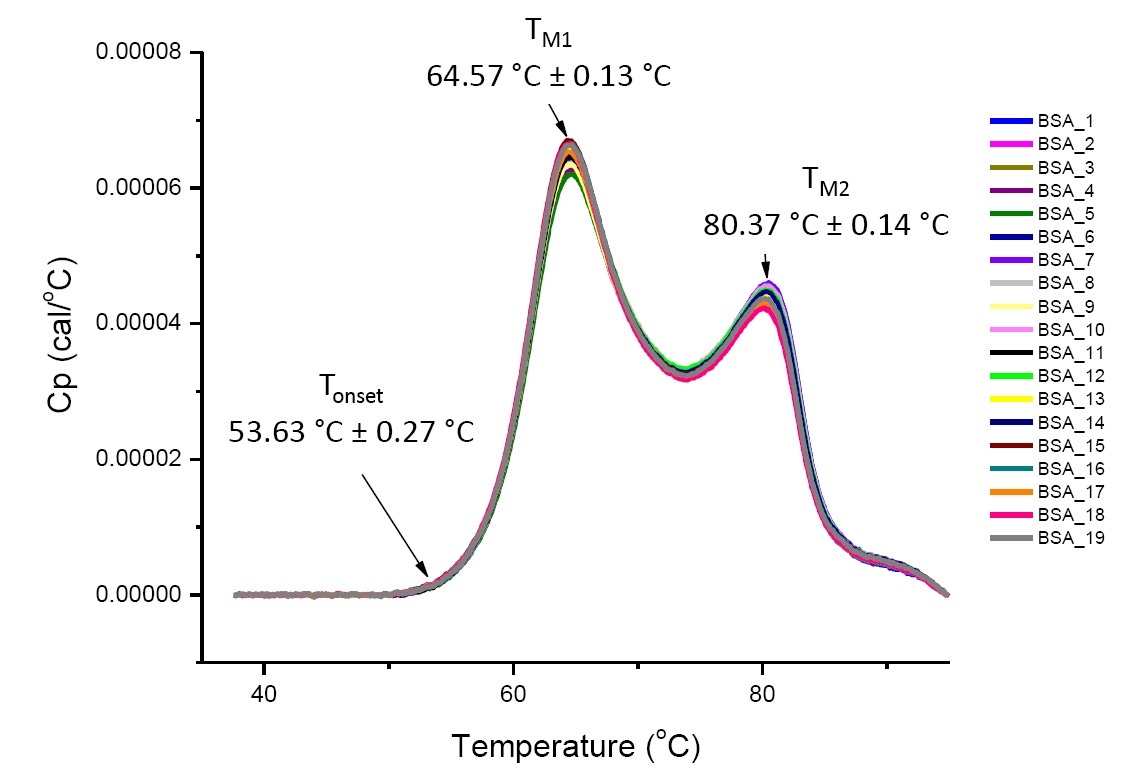
Figure 4 représentant 19 thermogrammes DSC d’albumine de sérum bovin (Sigma A1933, purifié par chromatographie) dans une solution tampon PBS. Les données de DSC qui apparaissent ont été déterminées suite à la normalisation de la fréquence de balayage, au passage d’une solution tampon à une autre et à la suppression d’une solution tampon. La moyenne et l’écart-type des valeurs Tonset, TM1, et TM2 sont indiqués.
Les résultats reproductibles et quantitatifs font de la DSC un outil fiable capable de déterminer la structure d’ordre supérieur lorsqu’il s’agit d’évaluer un produit pendant sa fabrication (comparabilité par lot et par site), de comparer les variantes protéiques et les produits modifiés (modifications de structure suite à une glycosilation, désamidation ou oxydation) et également lorsqu’il s’agit de biosimilarité. Les données de DSC figurent également dans les documents relatifs aux normes en tant qu’éléments importants pour déterminer la structure d’ordre supérieur indispensable à la fabrication de nouveaux procédés et de biosimilaires. Lors d’une enquête réalisée par des chercheurs en technologie biopharmaceutiques, la DSC a été définie comme étant une technique d’analyse très utile voire même extrêmement utile pendant la phase de sélection du produit candidat, du développement de la formulation, de la caractérisation du produit et ainsi qu'en termes de comparabilité et de biosimilarité[15].
Les valeurs TM peuvent être déterminées de manière très simple à partir des pics retrouvés sur les thermogrammes DSC et sans avoir recours à une analyse complexe des données. Comme nous l’avons précédemment démontré dans la figure 2, les thermogrammes DSC révèlent l’existence de plusieurs transitions lorsqu’il s’agit de protéines mutidomaines (anticorps) dite dénaturées. La DSC est capable d’identifier et de quantifier les différents domaines, elle peut déterminer les valeurs TM pour plusieurs transitions (deux, trois ou plus). Il existe d’autres tests biophysiques capables de déterminer la valeur TM tels que le dichroïsme circulaire (DC), la fluorimétrie différentielle à balayage (DSF), et la fluorescence intrinsèque (IF) mais ils peuvent uniquement mesurer la première valeur TM (générée aux températures les plus basses) ou la valeur TM la plus dominante pour des protéines multidomaines. L’extraction de plusieurs données spectroscopiques ou de fluorescence nécessite une adéquation complexe des données et ne peut être reproductible.
Par rapport à d’autres techniques d’analyse de la valeur TM, la DSC nécessite souvent plus d’échantillons de protéines par test et peut avoir une capacité d’analyse inférieure. Si l’échantillon est limité, il existe une solution qui consisterait tout d’abord à réaliser un classement par ordre de grandeur des valeurs TM soit par DSF ou IF puis de sélectionner plusieurs échantillons significatifs afin de valider la valeur TM par DSC. Il est important que cette étape de validation par DSC soit réalisée et que les techniques de fluorescence ou de spectroscopie ne soient pas considérées comme les seules à pouvoir mesurer la valeur TM lors des tests de stabilité. Les tests qui utilisent souvent la fluorescence connaissent des artéfacts qui brouillent les mesures et modifient les valeurs TM pouvant passer d’une valeur très basse à très haute et inversement. De plus, certaines protéines et solutions tampon ne sont pas compatibles avec la fluorescence, c’est pourquoi la DSF et L’IF ne conviennent pas. En définitive, la fluorescence et la spectroscopie sont incapables de mesurer l’enthalpie calorimétrique et de déterminer d’autres paramètres thermodynamiques définis par DSC.
La DSC qui est capable de déterminer la stabilité thermique est réputée être un test d’excellence par les chercheurs du secteur biopharmaceutique car cette technique :
Permet de mesurer les écarts thermiques liés à la dénaturation d’une protéine
Permet d’identifier le phénomène de dénaturation d’une protéine, c’est pour cela qu’aucun marqueur, sonde ou puce n’est utilisé (la DSC ne connaît aucun artéfacts contrairement aux tests spectroscopiques ou réalisés par fluorescence).
S’applique à des protéines natives en solution
Peut être utilisée avec la quasi-totalité des solutions tampon et additifs lors de la phase de purification et de formulation des procédés biopharmaceutiques. En revanche, nombreux sont les solutions tampons et additifs incompatibles avec la fluorescence et la spectroscopie.
Est facile à configurer et à maîtriser
Permet de contrôler très précisément la température même pour des températures atteignant plus de 130°C. Elle peut donc détecter les zones de transitions pour des valeurs TM très élevées. Avec la plupart des autres techniques d’analyse de la valeur TM, les échantillons sont uniquement chauffés à des températures jusqu'à 100°C, voire moins.
Repose sur un test de « dégradation forcée » et n’impose aucune utilisation de tampons chauffés pour conserver la protéine avant d’être analysée.
Permet d’extraire facilement les données et est pourvue d’un logiciel intégré capable de les analyser
Peut être utilisée pour détecter les périodes de transitions relatives à la dénaturation et caractériser les protéines multidomaines, les complexes protéiques ainsi que les protéines à domaine unique.
Permet d’accéder à un grand nombre d’informations et fournit des données thermodynamiques en plus de la stabilité conformationnelle et de la valeur TM déterminée.
S'utilise comme principal test pour caractériser la stabilité thermique de procédés biopharmaceutiques, peut être couplée à d’autres outils d’analyse biophysique complémentaires et orthogonaux et permet également de valider d’autres données.
Présente une automatisation à haut débit (système DSC MicroCal VP-Capillary) permettant d’analyser rapidement la stabilité thermique
Étant donné que les transitions relatives aux produits pharmaceutiques à base de protéines sont relevées dans le circuit dès la phase de recherche jusqu’à la phase de développement, il est important de créer une formulation appropriée, efficace et optimale capable de préserver sa stabilité, sa conformation et son efficacité pendant son transport, son utilisation et pendant toute la durée de son cycle de vie. La formulation doit être rentable à produire. Les formulations de protéines pouvant être auto-administrées et parfaitement adaptées au patient sont très demandées. C’est pourquoi le produit pharmaceutique doit être transporté et conservé dans une seringue pré-remplie ou dans un système d'administration qui n’impose aucune assistance médicale de la part d’un professionnel. De plus, le produit pharmaceutique doit être conservé à température ambiante ou au réfrigérateur. Certains produits biopharmaceutiques peuvent également être transportés sous forme lyophilisée, c’est pour cela que le médicament doit être solubilisé avant son administration.
Au début du cycle de développement, le volume d'échantillonnage disponible à des fins d’analyse est souvent restreint alors certaines sociétés développent la pré-formulation, étayée par des études biophysiques effectuées à petite échelle et capables de définir la composition tampon et le pH idéal permettant de stabiliser la protéine. Ce travail contribue également à créer une formulation qui sera utilisée en définitive pour que la protéine médicament soit soumise à des essais pré-cliniques et cliniques. Le développement de la pré-formulation peut être effectué au moment de la sélection du produit candidat pour évaluer le potentiel de développement du médicament, étant donné que de nombreux tests similaires sont inclus dans le processus d’évaluation.
Lors de l’étape de pré-formulation et de formulation d’un médicament, la protéine est exposée à des conditions différentes. On retrouve notamment :
Différents tampons, différentes valeurs de pH et différentes concentrations salines.
Différents additifs de formulation (excipients). Des excipients qui sont des matériaux inertes présents dans des formulations liquides et lyophilisées, permettant de stabiliser la protéine et favorisant la fabrication ou l'administration du médicament. Parmi les excipients souvent utilisés pour des produits biopharmaceutiques, on retrouve des tensioactifs (polysorbate 80), des sucres (tréhalose), des glycols (glycérol), des acides aminés, des conservateurs et des antioxydants
Des concentrations élevées en protéines, pour mesurer les taux de concentration auxquels le médicament candidat est soumis (dans plusieurs tampons et additifs) avant que les protéines ne soient agrégées.
Des différences extrêmes de température, de pression et d’humidité
Une alternance répétée de cycles de gel et de dégel (en présence d’interfaces air-liquide et de contrainte dûe au transport)
La présence d’une grande variété d’instruments, notamment des dispositifs de fermeture de contenant tels que les flacons, les seringues pré-remplies et les poches pour perfusion intraveineuse (IV)
Différents degrés de luminosité
Oxydants
Des essais de conservation en temps réel (capables d’évaluer la stabilité à long terme d’un produit médicamenteux en le conservant pendant une durée de vie de 2 ans) et des études fondées sur des essais accélérés et en conditions de contrainte à des températures élevées
Un article de 2016 rédigé par Kang et al.[16] avait pour sujet d’évaluer 37 formulations ayant été utilisées avec succès pour des anticorps monoclonaux à des fins commerciales. Le résumé de l’évaluation a souligné que :
12 formulations étaient lyophilisées et 25 étaient sous forme liquide (pour des concentrations allant de 2 mg/ml à 200 mg/ml)
Parmi les excipients, on a retrouvé des sels, des tensioactifs, des glycols, des disaccharides, des polysaccharides, des acides aminés et des antioxydants
Pour maintenir un pH optimal se situant entre 4,7 et 7,4, on utilisait fréquemment de l’acétate, du citrate, de l’histidine et des tampons Tris.
La plupart des formulations utilisaient un des trois tensioactifs : le polysorbate 80 (Tween 80), le polysorbate 20 (Tween 20) et le poloxamère 188
Toutes les formulations lyophilisées comprenaient des sucres (glycols/disaccharides/polysaccharides), alors que 30 % des formulations sous forme liquides comprenaient des sucres
Le chlorure de sodium (NaCL) était fréquemment utilisé
La glycine et l’arginine étaient des excipients à base d’acides aminés fréquemment utilisés
En solution aqueuse, une protéine est en équilibre entre sa conformation native (repliée) et sa forme dénaturée (dépliée). Les interactions hydrophobes et les liaisons hydrogènes sont des forces permettant d’assurer la stabilité d’une protéine et doivent être appréhendées dans l’ordre pour que la molécule se déplie et se dénature L'entropie conformationnelle affaiblit les forces stabilisatrices et permet à la protéine de se dénaturer. Lors de l’étape de développement de la formulation, l’objectif principal est de trouver des solutions qui offrent le meilleur degré de stabilisation et qui par conséquent permettent d’obtenir la plus grande proportion en protéines natives. Les protéines dénaturées ont tendance à être plus vulnérables à des processus chimiques irréversibles tels que la protéolyse, l’oxydation et la désamidation pouvant également entraîner l’inactivation et l’agrégation de la protéine.
Les outils de caractérisation biophysiques sont utilisés pour surveiller la conformation de la protéine, prédire la stabilité thermique et mesurer la formation d’agrégats en réponse à des conditions de formulation et de conservation. Les nombreux outils biophysiques mentionnés précédemment dans cet article figurent dans le circuit de développement de la pré-formulation et de la formulation. Parmi ceux-ci se trouvent la calorimétrie différentielle à balayage (DSC), la fluorimétrie différentielle à balayage (DSF), la diffusion dynamique et statique de la lumière (DLS et SLS), le dichroïsme circulaire (DC) et la fluorescence intrinsèque (IF). Ces tests permettent d’évaluer la stabilité conformationnelle de la protéine (en déterminant la valeur TM, Tonset et en décrivant le thermogramme DSC), la structure d’ordre supérieur, la taille des particules et la formation d’agrégats.
Le fait de classer par ordre de grandeur la valeur TM en utilisant la DSC est une méthode fréquemment utilisée pour mesurer le pH de la formulation et analyser les tampons et excipients. Généralement, plus la valeur TM mesurée est élevée, plus les protéines présentes dans la formulation sont stables (voir la figure 5 représentative des thermogrammes DSC lors de la mesure du pH de la protéine) et moins il y a de risque d’observer la formation d’agrégats pendant la conservation (voir l’étude de cas ci-dessous). La DSC est virtuellement compatible avec la quasi-totalité des tampons et excipient utilisés dans la formulation de produits biopharmaceutiques. Même si les transitions thermiques d’une protéine ont un caractère irréversible, la DSC est méthode rapide et pratique qui permet de mesurer et de classer par ordre de grandeur l’effet des solutions tampons et des excipients exercé sur la stabilité protéique tout au long du développement de la formulation.
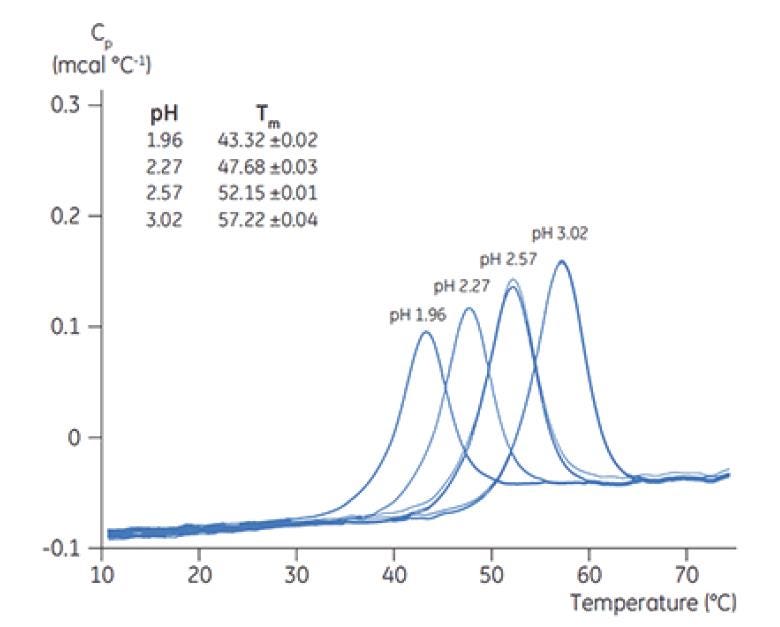
Figure 5. Thermogrammes DSC de chymotrypsinogène obtenus pour différentes valeurs de pH et présentant la valeur TM correspondant à chaque pH.
Les systèmes MicroCal VP-Capillary DSC sont utilisés par un nombre significatif d’importantes entreprises sous-traitante ou d'externalisation dans la fabrication de produits pharmaceutiques pour comprendre la stabilité conformationnelle et pour le développement de la formulation de procédés biopharmaceutiques. Parmi ces sociétés, on trouve Patheon[16], Fujufilm Diosynth Biotechnologies[17], et KBI Biopharma[18].
Les essais de stabilité accélérée ou « études de contrainte » sont monnaie courante dans l’analyse de la formulation. Ils consistent à conserver, à des températures élevées, la molécule candidate dans plusieurs formulations et permettent d’évaluer ces dernières sur tout un intervalle de temps pour comprendre les variations de stabilité conformationnelle, de taille ainsi que les modifications potentielles post-translationnelles et d’agrégation grâce à l'utilisation de la chromatographie d’exclusion stérique (SEC), de la calorimétrie différentielle à balayage (DSC) et de la diffusion dynamique de la lumière (DLS).
Une fois que le produit biopharmaceutique candidat est passé par toutes les étapes du développement et qu’il dispose d’une quantité suffisante de protéine, on examine les procédés impliqués dans la formulation et la production finale, on évalue les éventuels effets que pourrait avoir la concentration protéique et on chiffre l’incidence qu’ont les dispositifs d'administration. Les études de stabilité à long terme sont également réalisées pour prouver que la protéine médicamenteuse présente dans la formulation choisie possède des propriétés de stabilité et de conservation excellentes. Une formulation adéquate permettra de maintenir la structure d’ordre supérieur du produit biopharmaceutique pendant au moins deux ans.
Même si rien ne garantit que la stabilité thermique sera toujours liée à la stabilité physique d’une protéine pendant la phase de conservation, en général des TM élevées indiquent des besoins énergétiques importants nécessaires à la dénaturation de la protéine. Lorsque toutes les autres propriétés de la protéine sont similaires, la ou les formulations de protéines qui confèrent une meilleure stabilité thermique sont plus bénéfiques.
En 1998, Remmele et al.[19] ont publié un article portant sur l'utilisation de la DSC MicroCal pour évaluer la stabilité thermique du récepteur de l’interleucine-1 humaine recombinée dans des tampons utilisant différents excipients. Une étude de stabilité accélérée (à 30°C et à 50°C) utilisant le récepteur de l’IL-1 conservé dans des solutions de pH 3,9 a révélé l’existence d’une légère dégradation et agrégation de protéines à un pH 6 (réalisée par électrophorèse SDS-PAGE). Le thermogramme DSC représentatif du récepteur de l’IL-1 présent dans la solution « témoin » (citrate de sodium 20 mM, pH 6,0) fait apparaître la première TM à 48°C et la seconde à 65,5°C. 23 excipients différents ont été soumis à des tests, notamment les sucres (mannitol, lactose, sucrose et glucose), le glycols (polyéthylène glycol, glycérol et éthanol), les tensioactifs (Tween 80, Pluronic F68) des sels (NaCl et CaCl2) et des acides aminés (lysine, cystéine, alanine, arginine, glycine). Les excipients n’ont pas eu d’incidence sur la seconde TM, alors la température correspondant à la première transition thermique a été analysée pour analyser la stabilité. La stratégie consistait à rechercher les excipients provoquant une augmentation de la TM de la transition apparaissant à la température la plus basse, qui indique une évolution positive de la stabilité de la protéine native. La plupart des excipients soumis aux tests ont provoqué une chute de la TM (due à la stimulation du récepteur de l’IL-1) ou une légère hausse. L’additif responsable de la plus forte hausse de TM, signe d’une meilleure stabilité conformationnelle, contenait 100 Mm de NaCl, justifiant ainsi l’augmentation de la première TM passant de 48,1°C à 53,1°C. Les chercheurs ont éprouvé le besoin d’augmenter les concentrations de NaCL de 100 mM à 1500 mM et ont continué de constater une augmentation de TM. Ces résultats laissent supposer qu’il existe une meilleure stabilité thermique du récepteur de l’IL-1 en présence de NaCl et que cela est dû à la fois aux interactions de NaCl avec la protéine et aux éventuelles modifications observées dans la structure de l’eau. L’analyse approfondie des excipients a été réalisée en présence de 100 mM de NaCl.
D’après la même étude, les chercheurs ont observé l’effet que les conservateurs ont sur la stabilité du récepteur de l’IL-1 et sur l’agrégation. Des agents de conservation sont utilisés dans les formulations multidoses. Grâce à l’utilisation d’alcool benzylique, de métacrésol et de phénol, les thermogrammes DSC ont montré que les trois agents de conservations stimulaient le récepteur de l’IL-1. Parmi ces trois, le phénol avait le moins d’effet sur la stabilité thermique alors que l’alcool benzylique avait un effet stimulant très important sur les TMs. Ces résultats ont été vérifiés en procédant à l’analyse de la formation d’agrégats par chromatographie d’exclusion stérique après 7 et 60 jours de conservation à 37°C. Les échantillons contenant du phénol ont indiqué le plus faible degré d'agrégation tandis que ceux incubés avec de l’alcool benzylique ont révélé le plus haut degré.
Remmele et Gombotz[20] ont montré que la mesure de la TM par DSC était un bon indicateur révélant l’existence de CD40L impliqué dans l’agrégation. Grâce à une analyse de la stabilité du pH, les TM les plus élevées ont été mesurées pour des valeurs de pH situées entre 6 et 7,5 et qui lorsqu’elles sont corrélées à un pH compris entre 6 et 7,5 ont indiqué le plus faible pourcentage d’agrégats, comme le montre la SEC (après conservation à 37C pendant 7 jours).
Remmele[11] résume d’autres études qui s’appuient sur des données issues de thermogrammes DSC pour prédire, analyser et classer par ordre de grandeur la stabilité d’une protéine (le chymotrypsinogène et le pepsinogène) dans plusieurs formulations. Remmele a examiné la manière dont est utilisée la DSC conjointement avec d’autres techniques d’analyse (SEC-HPLC, CD, AUC, DLS, MS) pouvant nous aider à mieux comprendre la stabilité conformationnelle des procédés biopharmaceutiques présents dans différentes formulations. Ces informations peuvent ensuite être utiles pour prendre des décisions en vue de déterminer quelles sont les formulations susceptibles d’être intégrées dans les prochaines étapes.
D’autres études portant sur l'analyse de formulation confirment que les formulations avec des valeurs élevées de TM (mesurées par DSC) ont tendance à indiquer de faibles degrés d'agrégation lorsque ces dernières sont examinées par des études de stabilité accélérée et par chromatographie d’exclusion stérique couplée avec la chromatographie en phase liquide à haute performance[21-25].
Burton et al.[26] évalue l’usage qui est fait de la DSC en tant qu’instrument d'analyse rapide capable de mesurer la stabilité de deux petits anticorps modèles recombinés. Les variations de TM ont été contrôlées en fonction du pH et/ou des excipients et les résultats ont été comparés à des données de stabilité accélérée provenant d’échantillons analysés par SEC. Les données issues de la DSC MicroCal corrélées avec celles de la SEC (les échantillons avec des valeurs élevées de TM mesurées par DSC ont indiqué les plus faibles degrés d’agrégation mesurés par SEC) ont permis de définir le pH optimal de la solution et de déterminer l’effet des excipients sur la stabilité de la solution. Les valeurs de pH pour lesquelles les valeurs maximales de stabilité ont été estimées par DSC étaient de 7,5 pour la protéine 1 et de 6 pour la protéine 2. Ces valeurs correspondaient tout à fait aux estimations faites à partir d’études réalisées à plus long terme sur la stabilité de la solution pour chaque protéine. Pour conclure cet article, il est bon de citer les auteurs : « Les résultats de ces études indiquent que la microcalorimétrie peut être un instrument d’analyse précieux de la stabilité d’une protéine en solution, notamment lors de la phase préliminaire de caractérisation de la protéine et de développement de la formulation lorsqu’il y a peu de quantité produite... Cela peut permettre de réaliser d’importantes économies en termes d’exigences relatives aux substances médicamenteuses mais également en termes de temps et d’effort consacrés à la préparation des échantillons et à l’analyse des complexes ». [26]
Une demande de notification du laboratoire Malvern attire l’attention sur la manière dont le Dr. Katherine Bowers (Fujifilm Diosynth Biotechnologies) utilise la DSC lors du développement de la pré-formulation[27]. L’anticorps X a été introduit dans différents tampons avec un pH compris entre 3 et 8 et l’analyse de cet anticorps a été réalisée par DSC immédiatement (t = 0) puis après conservation pendant 1 semaine.
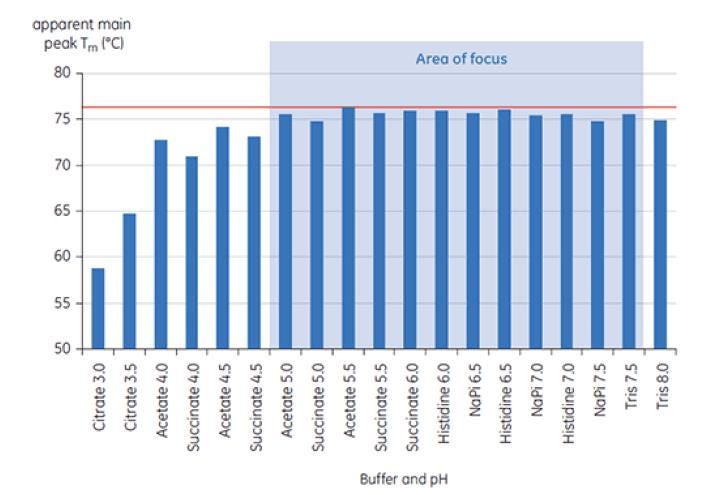
Figure 6 : Ensemble des valeurs de TM correspondant à l’anticorps X présent dans les tampons de pré-formulation. Les échantillons ont été analysés à l'aide du MicroCal VP-Capillary DSC de Malvern à t = 0.
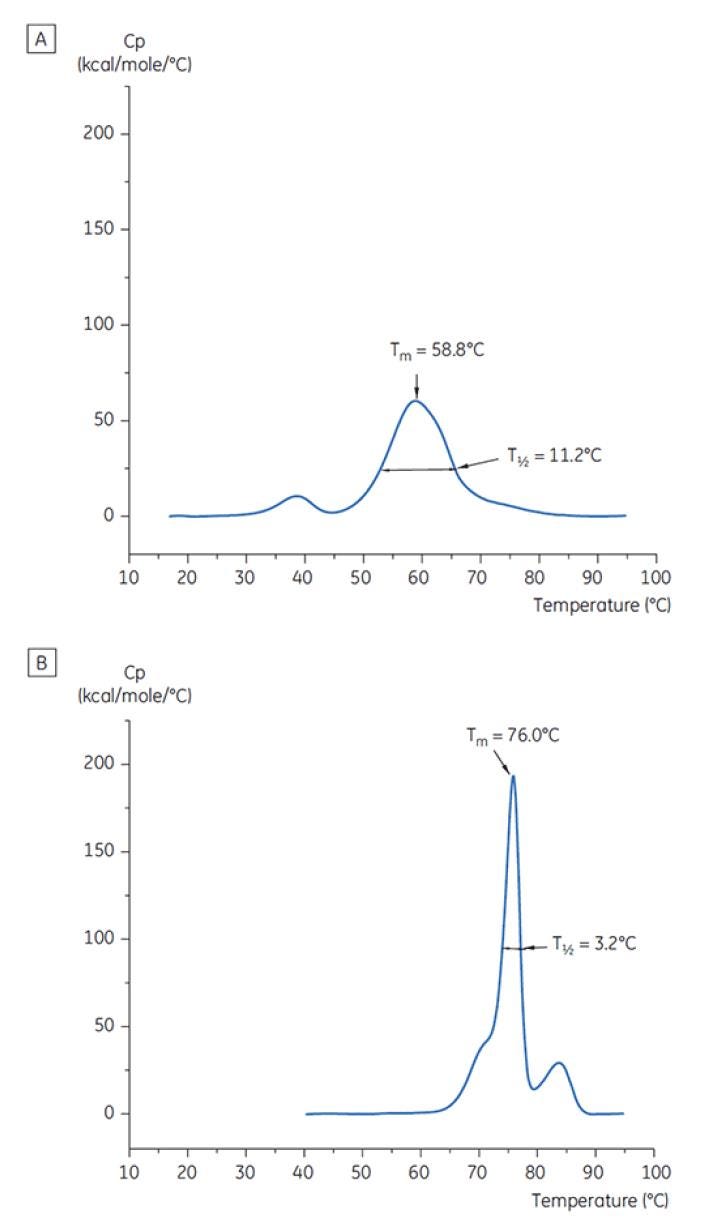
Figure 7 : Thermogrammes DSC de l'anticorps X à t = 0. (A) dissous dans un tampon citrate de pH 3,0 (B) dissous dans un tampon succinate de pH 6,0. Les valeurs TMet T½ sont indiquées pour chacun d’entre eux.
La figure 6 représente le pic principal de la TM à t = 0 pour l’anticorps X lors de la première analyse de pré-formulation et la figure 7 illustre le thermogramme représentatif de l’anticorps X dans un tampon citrate de pH 3,0 et de succinate de pH 6,0. À partir des valeurs de TM mesurées, on observe que les solutions tampons les plus stables se situent entre un pH de 5,0 et de 7,5. À t = 0, d’autres méthodes analytiques (UV, chromatographie d'exclusion stérique (SEC), diffusion de la lumière, et SDS-PAGE) ont montré une bien moindre différence entre les solutions tampon par rapport à la DSC (données non représentées).
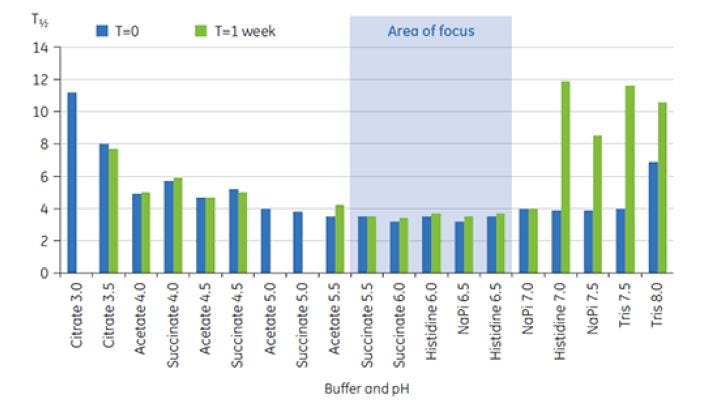
Figure 8 : Ensemble des valeurs de T½ pour la principale transition de TM correspondant à l’anticorps X présent dans les tampons de pré-formulation à t = 0 et à t = 1 semaine.
Les valeurs de T½ ont été utilisées pour mieux distinguer les solutions de formulation entre elles, comme cela est indiqué sur la figure 8. T½ correspond à la largeur du pic à mi-hauteur pour la transition principale du thermogramme DSC et reflète généralement l’ajustement de la transition thermique. Une valeur de T½ basse peut indiquer une structure plus compacte et est par conséquent préférable pour les formulations. Dans le cas présent, les valeurs de T½ les plus basses enregistrées après conservation pendant 1 semaine ont été trouvées pour les tampons dont le pH était compris entre 5,5 et 6,5 (figure 8). Ces données ont été utilisées pour classer les tampons et les intervalles de pH appropriés en vue de l’analyse préalable des excipients, ce qui a réduit considérablement le nombre de conditions exploratoires. Cette étude montre que la DSC peut être utilisée pour optimiser rapidement le pH et les solutions tampon lors du développement d'une pré-formulation.
Un produit biopharmaceutique est également caractérisé dans différents tampons et excipients pour comprendre le (les) processus de dégradation de la protéine. Cet élément facilite le développement de la formulation finale. En général, les médicaments pharmaceutiques ne se dégradent pas lorsqu’ils sont conservés au réfrigérateur pendant le développement de la formulation, et une étude de stabilité accélérée est donc fréquemment réalisée dans des conditions de contrainte et de températures, tel que mentionné précédemment dans plusieurs exemples. Une étude menée par Zheng et al.[28] a permis d’étudier la dégradation d’un anticorps monoclonal (AcMo) à usage thérapeutique de type IgG. Cette équipe a d’abord mesuré la réponse de l’anticorps monoclonal dans différents tampons (phosphate de sodium, citrate de sodium et acétate de sodium), différentes concentrations de NaCl (20 mM and 100 mM) et pour différentes valeurs de pH (pH 4,5, 5,5, 6,5 et 7,5) en utilisant le DSC MicroCal VP-Capillary. Les formulations candidates les plus prometteuses de chaque groupe tampon, reposant sur les valeurs de TM et Tonset les plus élevées, ont été sélectionnées à des fins d’évaluation approfondie : tampon de phosphate de sodium contenant 20 mM de NaCL à un pH de 6,5, de citrate de sodium contenant 20 mM de NaCL à un pH de 6,5 et d’acétate de sodium contenant 20 mM de NaCL à un pH de 6,5. L’anticorps monoclonal présent dans ces 3 tampons a indiqué des valeurs de TM et de Tonset similaires et a révélé l’existence de thermogrammes DSC presque identiques. À titre comparatif, cette étude a également analysé une formulation dans de l’acétate de sodium contenant 20 mM de NaCL à un pH de 4,5, ayant une transition thermique et une TM plus faible.
Les auteurs ont conservé l’anticorps monoclonal dans les 4 formulations à 40°C et les protéines ont ensuite été caractérisées par SEC (pour séparer les produits issus de la dégradation de la protéine native), par DLS (pour déterminer le second coefficient de Viriel capable de décrire les interactions entre protéines, par chromatographie en phase liquide couplée à la spectrométrie de masse (LC-MS) (pour classer les produits issus de la dégradation), par chromatographie par interaction hydrophobe (pour séparer les produits issus de la dégradation de la protéine native) et par SDS-PAGE (pour déterminer le poids moléculaire des produits issus de la dégradation). On a observé que la conservation dans un tampon à un pH de 4,5 provoquait plus de fragmentation par rapport à une conservation dans le même tampon à un pH de 6,5. De plus, la conservation à un pH de 4,5 a provoqué la dénaturation du fragment CH2, permettant à l’anticorps de mieux se fixer et facilitant sa fragmentation. Même si la DSC a montré que la structure conformationnelle de l’anticorps monoclonal était similaire, qu’il soit dans du phosphate à un pH de 6,5, du citrate à un pH de 6,5 ou dans de l’acétate à un pH de 6,5. Interprétés conjointement, les résultats de cette étude ont indiqué que les interactions entre protéines jouaient un rôle essentiel et qu’elles permettaient de prévenir la formation d’agrégats au niveau de l’anticorps monoclonal. Les auteurs ont également précisé que les connaissances acquises dans le cadre de cette étude étaient déterminantes pour pouvoir développer une formulation d’anticorps monoclonaux mais qu‘elle ne devrait pas être extrapolée à d’autres anticorps monoclonaux.
La protéolyse des molécules biopharmaceutiques pendant la phase de purification et de conservation peut également être source de préoccupations. Les protéases de la cellule hôte peuvent affecter la qualité des protéines recombinantes et entraîner la perte significative du produit. Les protéines dénaturées ou partiellement repliées sont plus sensibles à la protéolyse que les protéines avec une conformation repliée et ces dernières peuvent être protégées de la protéolyse par l’ajout d’osmolytes.
Lors d’une étude menée par Mueller, et al.[29], le mécanisme de protection d’une immunoglobuline de type M (IgM) contre la protéolyse a été étudié. Les IgM deviennent des candidats thérapeutiques mais elles sont réputées pour être intrinsèquement instables. Lors de cette étude, la pepsine, la papaïne et l'α-chymotrypsine ont été ajoutées à une IgM purifiée (mAb 85) et la dégradation a été analysée en l'absence et en présence d’excipients. Il a été confirmé grâce à l'utilisation du MicroCal VP-Capillary DSC que l’ajout d’excipients tels que la glycine et le sorbitol avait pour effet d’augmenter la stabilité conformationnelle du mAb 85. La dénaturation du mAb 85 observée lors des transitions thermiques 2 à 3 est dépendante du pH du tampon. Ces transitions correspondent aux différents fragments ou zones de structure. On a observé que l’ajout de 20 % de sorbitol ou de 1 M de glycine augmentait significativement les TM. Il y a eu une augmentation de température passant de 4 à 5°C avec l’ajout de sorbitol ou de glycine et passant de 7 à 11°C avec l’ajout de sorbitol et de glycine à des pH de 5,5 et de 7,5. Cela conduit à s’interroger sur les propriétés protectrices du sorbitol et de la glycine et la question se pose de savoir comment ce mécanisme de protection apparaît. Une des explications possibles est que les protéases sont inhibées par la présence d’excipients, peut-être par le fait qu’elles subissent des modifications de leur structure les rendant compactes. Il est également possible que l’IgM devienne compacte, lui conférant ainsi une structure plus réticente au clivage protéolytique.
Pour comprendre le mécanisme, le clivage protéolytique de substrats de faible poids moléculaire a été analysé. Ces substrats ne sont pas stabilisés par leur conformation compacte via le phénomène d'exclusion préférentielle. L’activité de la papaïne a légèrement augmenté tandis que celle de la chymotrypsine est restée pratiquement identique, ce qui laisse supposer que les excipients pourraient permettre de stabiliser la papaïne sans inhiber son activité. Ces résultats montrent que l’effet protecteur des excipients est rendu possible uniquement grâce à la stabilisation de conformation du mAb 85, et notamment à une compacité accrue et à une moindre accessibilité des sites de clivages pour les protéases. L’ajout d’excipients tels que le sorbitol et la glycine aux tampons pendant la purification et la formulation peut donc permettre de réduire ou même de supprimer l'utilisation d’inhibiteurs de protéases dans les formulations biopharmaceutiques.
Dans un article de Morar-Mitrica et al., un exemple explique la façon dont la DSC et d’autres méthodes biophysiques peut être utilisées dans le développement de la formulation spécifique à un système particulier d'administration. [30]. L’otelixizumab est un anticorps monoclonal humanisé (IgG1) dirigé contre l’antigène CD3 humain. Étant donné que les doses cliniques administrées sont faibles (de 0,1 mg à 0,5 mg par dose), le produit thérapeutique a été développé à une concentration de 0,2 mg/ml. La dose à administrer nécessite la dilution de l’anticorps monoclonal dans une poche pour perfusion intraveineuse contenant des solutés salins puis il faut employer une pompe à perfusion pour administrer le contenu de la poche. On a retrouvé des concentrations en protéines très basses dans la poche pour perfusion intraveineuse de l'ordre de 0,002 mg/ml. En raison de la faible concentration en protéines, on pouvait conclure à l’existence d’un risque élevé de pertes protéiniques due à l’interaction avec la poche pour perfusion intraveineuse et/ou avec le système de pompe à perfusion. Au cours de la phase de développement conventionnel de la formulation biophysique et d’après des études de stabilité en cours d'analyse, un produit thérapeutique a été développé permettant de réduire les pertes d’absorption, d’inhiber le processus de dégradation oxydative et d’avoir une formulation liquide stable dans des conditions de réfrigération.
Quant à l’analyse standard de la formulation, les valeurs de TM pour l’otelixizumab en présence ou en l’absence de 0,1% de polysorbate 80 (PS80) étaient définies à partir des thermogrammes DSC. Les thermogrammes de protéines en présence ou en l’absence de PS80 étaient identiques et présentés un profil de dénaturation uniforme, ce qui montre qu’il n’y a eu aucune modification de la structure d’ordre supérieur en fonction du surfactant. Au moins deux espèces/domaines, correspondant à 2 transitions de dénaturation, ont été clairement identifiés par DSC. Les résultats de la DSC pour l’anticorps monoclonal en présence ou non de PS80 n’ont révélé aucune variation significative que ce soit de la TM1 ou de la TM2. De plus, le PS80 n’avait aucun effet sur la stabilité thermique de l’anticorps monoclonal, comme en atteste la comparaison de paramètres thermodynamiques spécifiques dérivés de la DSC tels que la T1/2 et l’enthalpie de dénaturation.
Les peroxydes peuvent être présents en grande quantité dans des matériaux bruts comme les polysorbates, provoquant des effets oxydants néfastes pour les produits biopharmaceutiques et entraînant des conséquences telles qu’une réduction d'efficacité et une réponse immunogénique indésirable. Pour évaluer le risque d’oxydation en tant que voie de dégradation, l’otelixizumab présent dans le tampon d'histidine (sans PS80) a été oxydé par traitement au peroxyde d'hydrogène et les modifications de structure induites par l’oxydation ont été analysées par DSC puis comparées à un témoin non-oxydé. L’analyse de la TM a indiqué une déstabilisation de la première transition de dénaturation induite par l’oxydation, généralement attribuée au fragment CH2 de l’anticorps monoclonal. On a noté une diminution significative de la TM1 (la transition à basse température) correspondant à l’élargissement du pic. La seconde transition (TM2) n’a pas été affectée par l’oxydation. L’analyse de la spectrométrie de masse (SM) a confirmé qu’un résidu méthionine exposé sur le fragment CH2 était oxydé à 90% par le peroxyde. Ces résultats ont démontré que le principal site voué à l’oxydation était le résidu méthionine exposé sur le fragment CH2 et que le phénomène d’oxydation était en corrélation avec la déstabilisation thermodynamique de ce fragment. Les auteurs en sont venus à la conclusion que l’administration d’anticorps monoclonaux à usage thérapeutique à faible concentration présente des défis et qu’il est primordial que l’élaboration de la formulation et les études de stabilité en cours d’analyse soient réalisés très tôt dans le développement.
Les résultats présentés dans cet article illustre clairement l’importance et l’efficacité d’intégrer la DSC en tant que test biophysique de stabilité pendant l’étape de pré-formulation et de formulation. L’interprétation des résultats issus de la DSC et d’autres tests de stabilité a permis aux sociétés biopharmaceutiques de prendre des décisions éclairées sur les formulations les plus stables, ce qui signifie que la protéine est moins susceptible de présenter des problèmes de stabilité à long terme et d'agrégation dans sa formulation finale et en tant que médicament. Cela se traduit par une production plus rentable et une probabilité accrue de voir la formulation médicamenteuse finale rester active, stable, viable et sous sa forme native correctement repliée.
Analytical Techniques for Biopharmaceutical Development, R. Rodriguez-Diaz, T. Wehr, S. Tuck (eds.), Taylor & Francis, New York USA (2005).
Biophysical Characterization of Proteins in Developing Biopharmaceuticals, D.J.Houde, S.A. Berkowitz (eds.), Elsevier, Amsterdam, Netherlands (2015).
Biophysical Methods for Biotherapeutics: Discovery and Development Applications, T.K. Das (ed.) John Wiley & Sons, Hoboken NJ USA (2014).
Biophysics for Therapeutic Protein Development, L.O. Nahri (ed.), Springer NewYork, USA (2013).
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal AntibodyCharacterization Volume 1. Monoclonal Antibody Therapeutics: Structure, Function, and Regulatory Space, J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Vol 1176 (2014). doi: 10,1021/bk-2014-1176.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 2. Biopharmaceutical Characterization: The NIST mAb Case Study, J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Vol 1201 (2015). doi: 10,1021/bk-2015-1201.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 3. Defining the Next Generation of Analytical and Biophysical Techniques, J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Vol 1202 (2015) DOI: 10,1021/bk-2015-1202.