원료 의약품[active pharmaceutical ingredient (API)]의 개발에 있어서 권장 취급 조건을 사용하는 장기간의 보관 기간 동안에 적절한 안정성을 제공하는 처방을 설계하는 것이 중요하다 액체 처방은 제조 도중에는 취급하기 용이하고 경제적인 방식이며 또한 최종 사용자에 있어서도 편리하다. 많은 단백질은 안정적인 용액으로 처방하기에는 매우 어려운 것으로 입증되었으며 종종 동결 건조를 필요로 한다. 재조합형 인체 알부민인 Recombumin은 불안정한 API에 대한 액체 처방의 개발을 지원하기 위하여 개발되었다.
Recombumin은 Novozymes Biopharma UK Ltd이 제조하며 사카로미세스 세라바시아 효모 유도 단백질이다. 이는 인체 혈청 알부민(HSA)과 구조적으로 동일하다. Recombumin 그 자체는 pH 7로 처방되어 있으며 보존 기간이 5°C에서 5년을 초과하는 것으로 밝혀졌다[1].
이는 처방 안정성을 평가하기 위해 어떻게 광산란 기법이 사용될 수 있는지 탐색하기 위하여 Novozymes Biopharma UK 에서 제조하는 Recombumin 또는 Albucult(둘은 재조합형 HSA이나 처방이 다름)를 사용하는 응용 노트 중의 하나이다. 이 응용 노트는 온도를 증가시키면서 열림(unfolding)과 응집을 시행함으로써 API가 처방될 수 있는 다양한 pH 조건에서 Recombumin의 열적 안정성을 연구하였다. 이러한 지식은 분자가 안정적인 액체 처방을 제공하기 위한 최적의 pH 범위를 결정할 수 있게 한다.
다른 pH 값의 Recombumin 샘플은 Novozymes Biopharma UK가 제공하였다. Recombumin 샘플은 20% 스톡 용액으로부터 25mM 이온 강도의 완충액에서 10mg/ml로 20배 희석되었다 - 구연산염 pH 3, 4, 5, 6, 인산염 pH 6, 7, 8 그리고 붕산염 pH 8, 9, 10. 각 샘플의 이온 강도는 염화나트륨을 이용하여 0.9% w/v 염화나트륨에 상응하는 것으로 만들었다. 샘플은 세균 여과를 하여 2mL 부분시료로 만들었으며 측정 시점 전에 약 6개월 동안 5°C에서 보관했다.
샘플은 여러 샘플에 대하여 동적 광산란(DLS)을 이용하는 자동화된 플레이트 샘플러 시스템인 Zetasizer APS로 측정되었다.
모든 샘플은 큰 응집물이 측정 전에 제거되도록 하기 위하여 0.02μm 필터로 여과하였다. 이는 모든 샘플이 유사하게 낮은 함량의 커다란 응집물을 갖도록 하기 위한 예방 단계이다. 고농도의 단백질의 분석관련 응용 노트에서 보는 바와 같이 이러한 단백질 처방은 단분산이다[3]. 여과에 의한 큰 응집물과 분진과 같은 다른 오염물의 제거는 그것들이 샘플의 응집 과정에 영향을 미치지 않도록 하기 위하여 시행되었다. 응집은 응집물의 존재가 샘플의 응집 속도에 영향을 미치는 경우 핵에 의존하는 과정이다.
열적 경향 측정은 25°C에서 개시되어 1°C 씩 20초의 평형 시간을 두면서 85°C로 증가시켰다. 1회의 DLS 측정이 각 온도에서 시행되었다.
샘플이 응집하기 시작하는 온도는 응집 온도 Tagg 또는 용융 온도 Tm이라고 불린다. 이는 예를 들면 2차 구조 요소의 상실을 보고하는 원이색법에서 측정되는 것과 동일한 용융점이 아니라는 것을 유의하는 것이 중요하다[4].
측정된 온도 범위에서 단백질 단량체의 유체역학적 반경의 변화는 pH 3 ~ 10으로 처방된 Recombumin 샘플에 대하여 그림 1에 나타내었다. 대부분의 샘플은 67 ~ 68°C의 유사한 Tm을 보이는 것으로 밝혀졌다 pH 6에 처방된 2개의 샘플(구연산염 완충액 및 인산염 완충액)은 74°C Tm 이상까지도 응집을 시작하지 않으므로 훌륭한 안정성을 보였다.
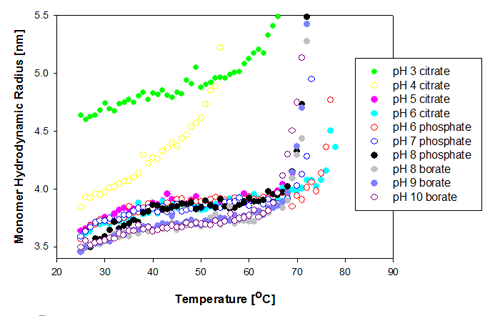
|
거동에서 나머지와 상당히 다른 2개의 샘플은 pH 3 및 pH 4에서 조제된 것이었다. pH 4 샘플이 처음으로 풀리기(unfolding) 시작했으며 풀림(unfolding) 속도는 다른 샘플의 속도와 달랐다. 온도에 대한 감도는 이것이 모든 샘플 중에 가장 안정성이 떨어지는 것을 나타낸다. pH 3의 Recombumin는 다른 샘플보다 훨씬 큰 반경에서 시작했다. 이는 아마도 샘플에 존재하는 상당한 양의 이량체 때문일 것이다. 이는 SEC 데이터의 사례로 드러났다[2]. 이량체와 단량체는 DLS가 그것들은 2개의 피크로 분리하기에는 크기가 너무비슷하므로 피크 평균값이 더 크게 되었다. 분자량은 잘 정립된 관계로부터 유체역학적 크기로 변환될 수 있다[5]. 그러한 관계로부터, Recombumin 단량체는 3.57nm의 예상 유체역학적 반경을 갖는 반면 이량체는 4.8nm의 Rh를 갖게 된다. 그림 1에서 측정된 유체역학적 반경은 4.8nm에 근접하는 것으로 밝혀졌으며 그러한 사실로부터 샘플에는 상당한 비율의 이량체가 존재하는 것으로 결론을 내릴 수 있었다. 소형 올리고머의 검출에 대해서는 응용 노트를 참고하기 바란다[6].
이량체가 사용된 필터 pore 크기(20nm)보다 작으므로 필터를 통과하는 것으로 예상된다.
DLS의 응집 온도는 응집된 분자에 의해 증가된 산란으로 인하여 어디에서 신호가 증가하기 시작하는지 검출하기 위하여 산란 신호에 대한 선형 근사에 의해 측정된다. Recombumin 샘플에 대한 응집 온도는 그림 2에 나타나 있다. 이러한 데이터는 열적으로 가장 안정한 샘플이 pH 6에 있는 Recombumin이므로 크기 변화는 산란의 변화와 직접 관련이 있다는 것을 확인해 준다. 그 후에 pH 5, 7, 8, 9에 있는 Recombumin 샘플도 매우 유사한 용융점과 열적 안정성을 보였다. 이러한 데이터는 Recombumin 샘플이 이 pH 범위에서 안정하다는 것을 나타낸다.
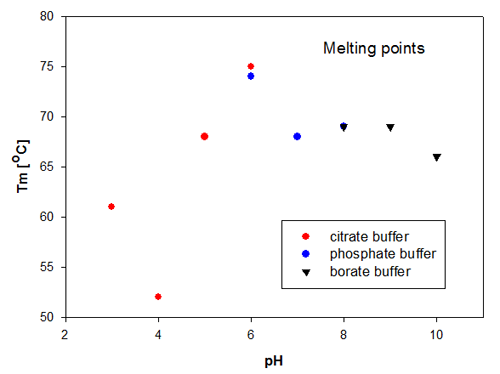
|
pH 범위의 종점 즉 pH10 및 pH 3은 더 낮은 융점을 보였다. 상당히 최저인 열적 안정성이 pH 4의 Recombumin에서 나타났으며 이는 52°C에서 응집을 개시했다. 용융 온도/응집 온도의 측정은 Recombumin이 2개의 다른 완충액에서 동일한 pH로 처방된 경우에 매우 재현성이 있는 것으로 나타난 것은 주목할 만하다.pH 6 및 pH 8 샘플 참조.
DLS을 사용한 열적 경향 측정을 예측할 수 있는 가능성을 검증하기 위하여 용융점 온도가 장기적인안정성 측정과 비교되었으며 여기서는 동일한 샘플이 조제 이후 6개월 및 9개월에 측정되었다. 샘플은 이러한 측정 전에 그리고 측정 사이에 2 ~ 8°C로 보관했다. 그림 3a 및 3b는 유체역학적 크기에 의해 표시되는 샘플의 변화를 보여주며 여기에서는 pH 3 및 pH 4에 있는 샘플이 측정한 pH 범위 내에서 가장 불안정한 Recombumin 샘플이었다.
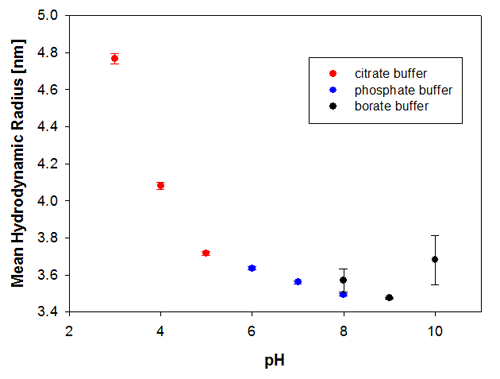
|
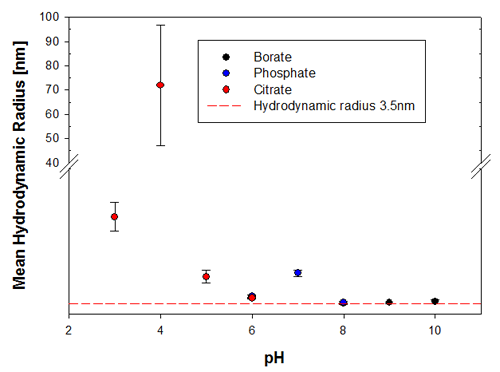
|
이 응용 노트에 나타낸 바와 같이 DLS에 의한 열적 경향은 단백질 처방의 안정성을 예측할 뿐만 아니라 어떻게 단백질이 열적 스트레스에 반응하는지 모니터링 하는데 유용하다. 이 정보는 제조 공정 및 샘플 취급 권장사항 설계 시에 유용하다.
[1] “Investigating the stability of recombinant human serum albumin under a range of pH conditions with both time and temperature”
Poster presentation by Mr Karl Nicholls, May 2010, BPI Europe 2010, Vienna - Austria
[2] MRK1616 GP 1616 App note GP.HPLC & DLS
[3] MRK1614 App note high conc protein data
[54] L Masino, SR Martin and PM Bayley “Ligand binding and thermodynamic stability of a multidomain protein, calmodulin” in Protein Science (2000) 9: 1519-1529
[56] P Claes, A Kennedy and P Vardy “An on-line dynamic light scattering instrument for macromolecular characterization” in “Laser light scattering in biochemistry” SE Harding, DB Sattelle and VA Bloomfield (eds) pp 66-76 RSC (1992)
[6] MRK1615 app note small oligomer detection