이 응용 노트는 생산성 향상에 필요한 적은 샘플 소비량과 고처리량을 제공하는 Malvern MicroCal iTC200을 분석 개발에서 선도 물질 최적화에 이르기까지 작업 흐름에서 구현하는 방법을 설명합니다.
제약 연구의 목표는 치료면에서 유용한 반응을 유발하는 대상의 활성을 조절하는 것입니다. 약물은 대개 생리적 대상의 활성을 조절하고 결합되는 경우에만 효과적입니다. 따라서 초기 단계의 약물 발견은 약물 후보 물질의 대상 친화도 및 선택성의 최적화에 중점을 둡니다.
등온 적정 열량측정법(ITC)은 저분자와 단백질의 상호 작용에 대한 열역학적 결합 매개 변수를 측정하는 데 널리 사용됩니다. 결합 친화도(KD), 화학량(n), 자유 에너지(ΔG), 엔탈피(ΔH), 및 엔트로피(ΔS)의 동시 측정은 약물 발견 공정의 다양한 단계에서 중요한 정보를 제공합니다.
다음 예는 MicroCal iTC200 시스템으로 제공한 자세한 결합 정보가 약물 발견의 다양한 단계에서 어떻게 도움이 되는지를 보여 줍니다.
한 연구는 분석 개발 동안 대상 단백질에 대한 펩타이드 결합을 평가하는 것과 관련되어 있습니다. 이 연구의 목표는 잠재적인 원료 의약품과 대상 단백질의 결합 메커니즘을 잘 파악하는 것입니다. 또한, 그 결과로 나타난 데이터 특히, 화학량(n) 및 친화도(KD)는 후속 대상 단백질 조제물의 활성과 품질을 평가하는 데 사용할 수 있습니다.
두 번째 응용 분야에서는 ITC를 1차 검사 후 대상 단백질에 대한 유효 물질 결합을 검사하는 직교 방법으로 사용합니다. 생화학적 분석 데이터 및 다른 생물물리학적 기법(예: 표면 플라즈몬 공명(SPR) 및 핵자기 공명(NMR))으로 도출한 데이터와 결합된 ITC의 확실한 결과는 진정한 유효 물질과 위양성 물질을 정확하게 구별하는 데 도움을 줍니다.
마지막 연구에서는 선도 물질 최적화 단계에서 화합물에 대한 자유 에너지의 엔탈피 및 엔트로피 기여도를 조사합니다. 결합 친화도(KD), 화학량(n), 자유 에너지(ΔG), 엔탈피(ΔH), 및 엔트로피(ΔS)의 동시 측정은 선도 물질 화합물의 향후 개발을 뒷받침하는 중요한 정보를 제공합니다. 결합 에너지에 대한 엔탈피(ΔH) 및 엔트로피 기여도는 잠재적인 약물이 대상 물질과 어떻게 상호 작용하는지에 대한 단서를 제공합니다. 이 정보는 구조-활성 관계를 구축하고 컴퓨터를 이용한 약물 설계를 지원하는 데 사용할 수 있습니다.
기존 방법론과 연관된 단백질과 화합물의 소비량이 상당하므로, ITC가 단일 실험에서 이와 관련된 유용한 정보를 제공하지만 ITC를 약물 발견에 광범위하게 적용하지는 못하고 있습니다. MicroCal iTC200를 소개하면서 이러한 문제를 다루었습니다. 기존 버전의 ITC 시스템에 비해 이 시스템은 샘플 소비량이 7배 정도 줄어들었고 평형 시간이 2배 ~ 7배나 빨라져 이러한 결과가 높은 처리량으로 전환됩니다.
모든 단백질, 펩타이드 및 저분자 화합물은 Hoffmann La-Roche의 사내에서 생성됩니다. MicroCal iTC200 장비는 Malvern Instruments에서 사용할 수 있습니다. 모든 실험은 25°C에서 실시했습니다.
완충액은 사용 전 가스를 제거했습니다. 샘플 셀은 50mM HEPES, pH 7.4, 100mM NaCl, 0.5mM TCEP 및 5% DMSO의 Bcl-2(30µM 용액)로 채웠습니다. 펩타이드는 동일한 완충액에서 250µM의 농도로 희석했습니다. 주입 용량은 각각 3 µl이고 주입 시간은 6초이며 각 주입 사이의 지연 시간은 150초였습니다. 데이터는 MicroCal-enabled Origin™ 소프트웨어(OriginLabs)를 사용하여 분석했습니다.
|
ITC 데이터 특히, 화학량(n) 및 친화도 상수(KD)는 단백질 조제물의 품질을 평가하는 데 사용했습니다.
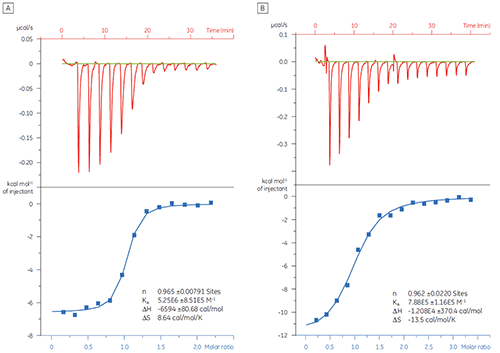
이 예에서 두 가지 다른 펩타이드와 대상 단백질 Bcl-2(B 세포 림프종 2에서 파생된 이름)의 상호 작용은 MicroCal iTC200으로 연구했습니다. 결과는 그림 1에 나와 있습니다. Bcl-2 단백질에 대한 BAD 유사(Bcl-2 관련 사망의 결정적 요인) 펩타이드의 결합 친화도는 BAX(Bcl-2 관련 X 단백질) 펩타이드의 결합 친화도보다 6배나 강합니다.
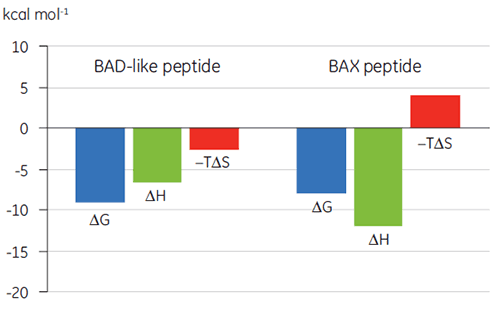
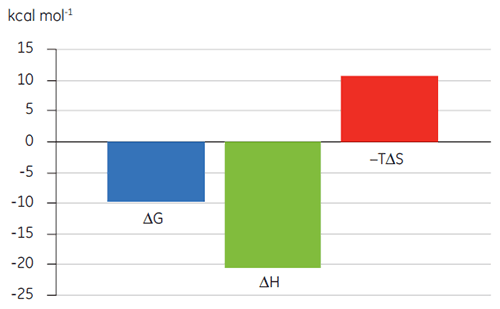
결합 특성 플롯 형태의 열역학적 매개 변수 시각화(그림 2)는 엔탈피 및 엔트로피 구성 요소가 ΔG로 표시된 전체 친화도에 어떻게 기여하는지를 보여 줍니다. 이 플롯은 Bcl-2에 대한 BAD 유사 펩타이드의 결합이 불리한 또는 유리한 결합 엔탈피(ΔH)와 엔트로피 요소(TΔS)로 표시된 극성 상호 작용과 소수성 상호 작용으로 구성되어 있습니다. BAX의 결합은 불리한 엔트로피로 표시된 구조적 변화와 관련되어 있습니다.
|
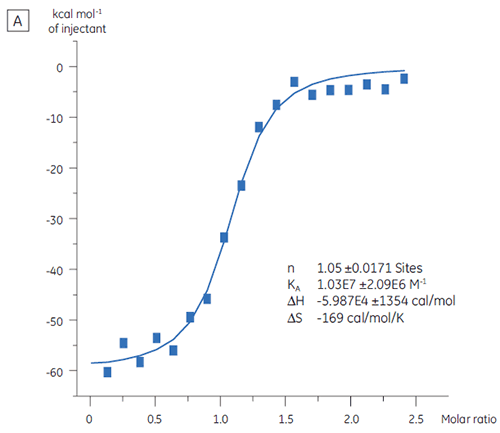
검사 캠페인에서 사용하기 전 대상 단백질의 결합 활성 수준을 평가하기 위해 ITC를 사용할 수 있습니다. 이 연구에서 두 배치의 대상 단백질은 97nM의 친화도로 대상 단백질에 결합된 양성 대조 펩타이드로 적정하여 비교했습니다(그림 3).
|
|
첫 번째 배치인 배치 A(그림 3 A)의 결과는 KD가 97nM이고 n = 1인 예상한 등온선과 완전히 활성화된 단백질을 보여 줍니다. 두 번째 배치인 배치 B(그림 3 B)는 KD가 135nM이나 n은 0.23이고 부분적으로 활성화된 단백질을 보여 줍니다. 단백질 농도로 10µM 대신 2.3µM을 사용한 동일한 세트의 데이터를 분석한 결과, 동일한 KD 값과 n = 1이 도출됩니다. 이를 통해 배치 B 단백질의 75%가 불안정화되었음을 알 수 있습니다. 배치 B 단백질은 검사 캠페인
용도로 사용하지 않았습니다.
초기 단계의 검사 캠페인에서 위양성 물질을 배제하는 것은 중요합니다. 대상 단백질(TP)에 대한 20µM 용액을 화합물 X로 적정했습니다(그림 4). KD(1/KA로 정의됨)는 4.9µM으로 측정되었고, SPR 과 NMR로 수행한 연구와 상관되어 있고 화합물 X는 진정한 유효 물질이며 향후 연구에 적합한 것으로 확인되었습니다.
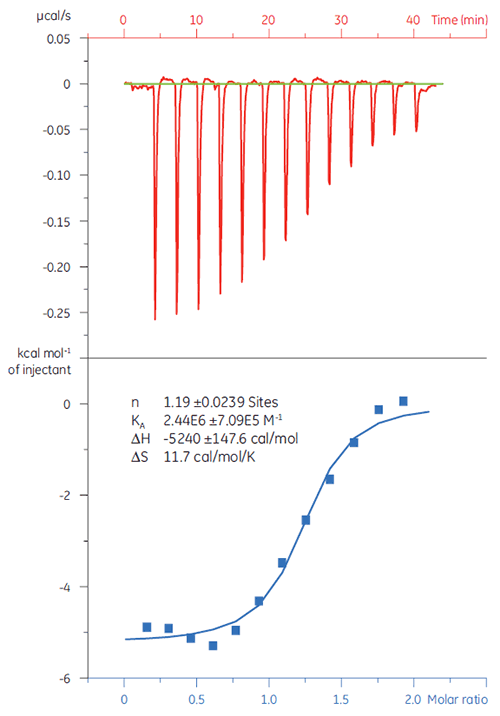
|
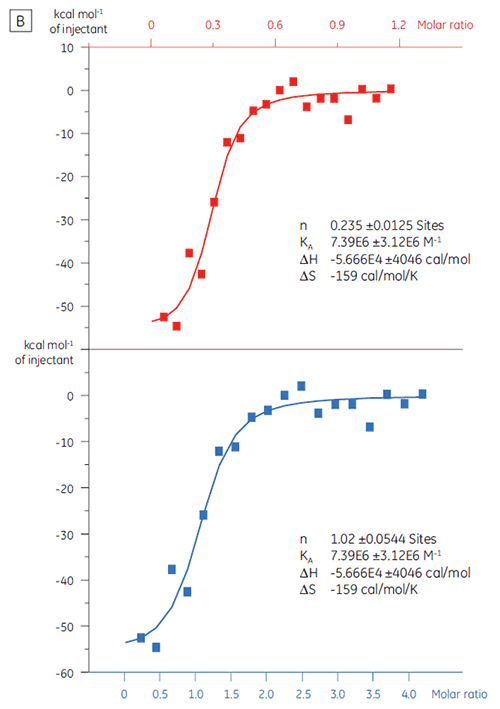
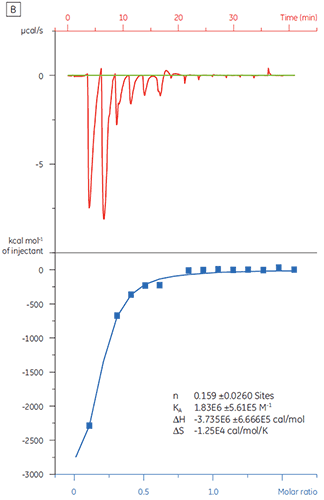
동일한 대상 단백질을 화합물 Y로 적정한 경우 결과가 매우 달라졌습니다(그림 5). 왼쪽 패널에서 화합물 Y는 TP로 적정했습니다. 등온선은 120nm의 겉보기 결합 친화도를 보여 주지만 결합 엔탈피는 예상한 것보다 1000배나 증가했고 화학량 값은 매우 낮았습니다(n = 0.01). 오른쪽 패널에서 동일한 약물 후보 물질을 소혈청알부민(BSA)으로 적정했습니다. 해당 결과는 비특정 활성을 나타냈습니다. 이 실험에 따라 화합물 Y는 위양성 물질로 간주되었고 향후 연구에서 제외되었습니다.
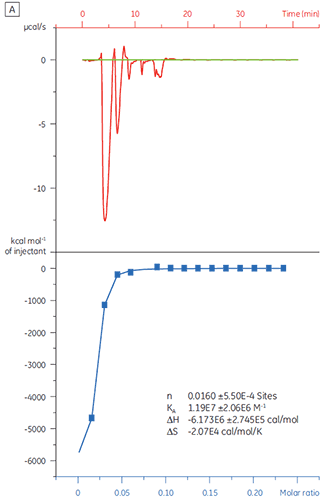
|
|
TP에 대한 화합물 A의 결합을 연구한 결과는 KD가 25nM임을 보여 줍니다. 이 상호 작용에 대한열역학적 조건을 분석하기 위해 ITC 실험을 실시했습니다(그림 6). 화합물 A의 100µM 용액은 TP의 10µM 용액으로 적정했고 KD 값은 65nM였습니다. 결합 특성의 경우(그림 7) 친화도는 엔탈피 상호 작용에 의해 주로 유도되지만 엔트로피 상호작용으로는 반대의 결과가 나타남을 보여 줍니다.
엔탈피 상호 작용은 수소 결합 및 반데르 발스 상호 작용에 의해 생성되고 유리한 엔트로피 결합 친화도는 소수성 상호 작용으로부터 유도됩니다. 이 예에서와 같이 불리한 엔트로피는 복합체에 대한 상호 작용 종의 자유도가 저하되어 발생합니다. 두 분자가 상호 작용을 하지만 효과의 크기는 단백질이 구조적 변화를 거치거나 리간드가 매우 유연한 경우와 관련되어 있습니다. 불리한 엔트로피가 감소하면 정의된 최적화 경로가 제공되고 이를 ITC로 추적할 수 있습니다.
엔탈피를 최적화하는 것은 결합 엔트로피 보다 더 어렵고 이 매개변수 중의 하나만을 사용하여 친화도 최적화를 수행하면 약동학 특성(지나치게 친수성이거나 소수성인 경우)이 충분하지 않은 화합물을 유발할 수 있습니다. 종합해 보면, 엔탈피로 유도한 유효 물질로 작업을 시작한 다음, 엔트로피가 향상된 경우에 '설계하는' 것이 좋습니다.
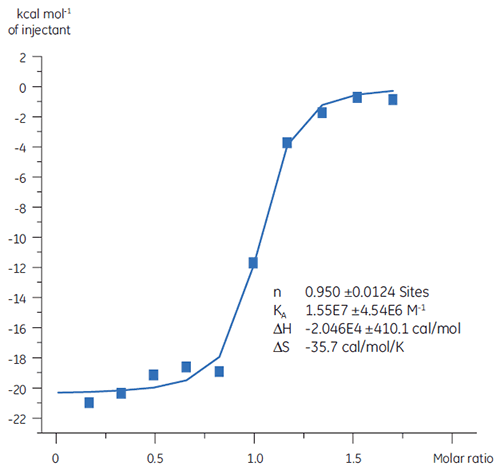
|
|
MicroCal iTC200을 사용하여 다음 사항을 보여 주는 약물 발견 작업 흐름에 ITC 기법을 통합했습니다.
이 데이터는 Dr. Lingao(Hoffman-La Roche, Nutley NJ, USA)가 제공했습니다.