바이오 의약품은 단백질과 같은 생체 분자로 만들어지는 약품입니다. 단백질 활성은 주로 단백질의 분자량 및 응집 상태로 정의됩니다. 단백질의 분자량, 올리고머 및 응집체 측정에 광 산란이 더욱 자주 사용되고 있습니다. SEC-MALS는 가장 흔한 광 산란 단백질 측정법 중 하나입니다.
Malvern의 Viscotek SEC-MALS 20은 단백질의 절대 분자량 및 올리고머 상태의 측정을 위한 20개의 검출 각도를 가진 다각도 광 산란 장비입니다. 이 장비는 또한 단백질 응집체의 분자량 및 크기에 대한 연구와 함께 합성 및 천연 고분자의 분석에도 사용할 수 있습니다.
Waters Alliance® 시스템은 단백질 분리에 자주 사용되며 특히 이 시스템의 강력한 소프트웨어인 Waters Empower® 때문에 바이오 제약 업계에서 인지도가 높은 제품입니다. 장치간 신호 전달에 사용할 수 있는 일반적인 아날로그 및 디지털 연결 덕분에 대부분의 SEC 시스템에 고급 검출기 추가가 가능하지만 소프트웨어 패키지는 종종 호환되지 않습니다.
이 응용 노트에서는 Malvern의 OmniSEC 소프트웨어를 사용하여 샘플 시퀀스의 원활한 교환을 위해 Waters Empower®와 통신이 가능함을 보여줍니다. 이를 통해 Waters SEC 시스템에서 주입을 수행하면 OmniSEC이 이를 따라 데이터 수집을 동기화하도록 합니다. 단백질 분자량, 올리고머 및 응집 상태의 측정을 보여주기 위해 선별한 단백질을 사용하였습니다.
Viscotek SEC-MALS 20을 e2695 펌프, 탈기 장치 및 오토샘플러 모듈로 구성된 Waters Alliance® 시스템과 e2414 RI 검출기에 연결하였습니다(그림 1). 주입 작업과 데이터 수집을 동기화하기 위해 오토샘플러 트리거 신호를 연결하였습니다. RI 검출기로부터 나오는 RI 아날로그 신호 출력은 SEC-MALS 20의 아날로그 입력 중 하나에 연결하였습니다. 유체 연결은 컬럼에서 나와 SEC-MALS 20을 통해 RI 검출기로 이어지도록 하였습니다. 배압 상승으로부터 유동 셀을 보호하기 위해 RI 검출기를 마지막으로 배관 라인에 연결하였습니다.
Waters Empower® 및 Malvern의 OmniSEC 소프트웨어는 동일한 PC에 설치하였습니다. ‘샘플 설정 방법’을 Empower®에서 생성하고 실행되도록 설정하였습니다. 그런 다음 OmniSEC에서 Empower ®
1mL/분의 속도로 PBS가 흐르는 Malvern PLS5030 SEC 컬럼에서 분리 작업을 수행하였습니다. 이들 컬럼은 단백질 분리를 위한 실리카 기반 컬럼으로서 높은 분해능과 낮은 입자 탈락 특성을 가지고 있어 단백질 광 산란 측정에 이상적입니다.
분자량 표준으로 소혈청알부민(BSA)을 실행하여 검출기 응답 보정 및 정규화에 사용하였습니다. 2가지의 시험 단백질인 펩신과 트립신 억제인자를 이동상에 용해시켰습니다. 트립신 억제 인자는 강한 응집 반응을 자극하기 위해 마이크로웨이브에서 10초간 가열하였습니다. 경험적으로 펩신 샘플에는 이미 상당량의 응집체가 포함되어 있습니다. 이어서 이 두 샘플을 약 2mg/mL의 농도로 주입하였습니다(100µL). 그런 다음 OmniSEC에서 결과를 분석하였습니다.

|
BSA 모노머 보정 결과는 사양 내에 있으며 다이머 분자량의 올바른 측정을 통해 정확한 값을 가지는 것을 보여주었습니다. 이어서 시험 단백질인 펩신과 트립신 억제인자를 측정하였습니다.
그림 2에서는 3개의 피크가 나타난 펩신의 크로마토그램을 보여줍니다. 9.7mL에서 용리되는 가장 잘 정의되는 피크는 명백하게 모노머임을 알 수 있으며 이의 분자량은 35kDa으로 정확하게 측정되었습니다. 더 이른 용리 피크는 매우 높은 다분산 분자량을 가지고 있으며 샘플 내 일부 크기가 큰 응집체로 인해 나타난 결과임을 알 수 있습니다. 모노머 이후에 잘 정의되지 않은 피크는 더 작은 분자량을 가지고 있으며 일부 분해된 단백질로 인한 결과입니다. 따라서 이 샘플은 Waters Alliance® 시스템과 연결된 SEC-MALS 20 검출기를 통해 모노머, 응집체 및 분해 산물 분자량을 측정할 수 있음을 명백하게 보여줍니다(그림 2).
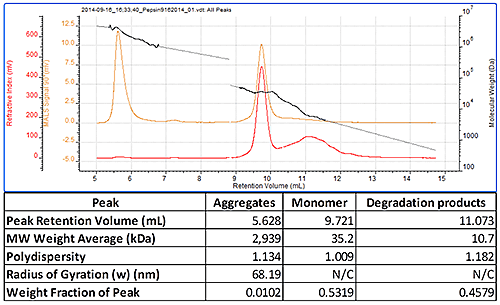
|
그림 3에서는 측정 전 응집 유도를 위해 마이크로웨이브로 가열된 트립신 억제 인자의 크로마토그램을 보여줍니다. 이 샘플은 분자량이 27kDa으로 측정된 모노머 피크를 보여줍니다. 모두 단일 피크로 분석되는 다수의 응집체 피크도 나타났습니다. 이 응집체는 약 450kDa의 높은 분자량을 가지고 있으며 이러한 응집체에 일반적으로 나타나는 다분산성을 보여줍니다.
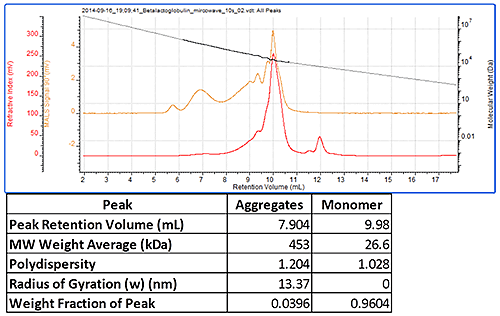
|
단백질 응집체의 분자 크기(Rg)가 크기 측정의 하한값(약 10nm)보다 큰 경우 이러한 분자 크기 측정에 MALS 측정을 사용할 수도 있습니다. 이는 산란된 광의 각도 의존성을 연구하여 측정할 수 있습니다. 여기서는 펩신 및 트립신 억제 인자 응집체의 크기를 서로 비교하였습니다. 펩신 응집체는 분자량이 거의 3백만Da에 이르고 측정된 크기는 68nm로 매우 큽니다. 반면에 트립신 억제 인자의 응집체는 분자량이 약 450kDa이었지만 크기는 훨씬 작은 13nm이었습니다. 각도 의존성 그래프의 차이는 그림 4에서 명백하게 확인할 수 있으며 대략 동일한 분자량(10,000kDa)에서 2가지 샘플의 단일 데이터 슬라이스를 보여줍니다. 분자량은 유사하지만 펩신 응집체의 크기는 트립신 억제 인자의 15.5nm와 비교하여 75nm로 측정되었습니다.
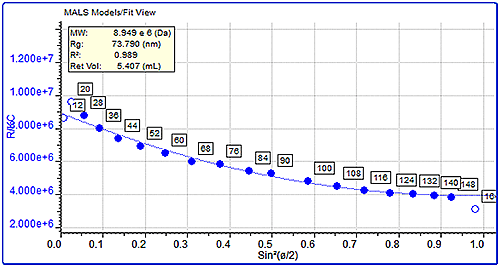
|
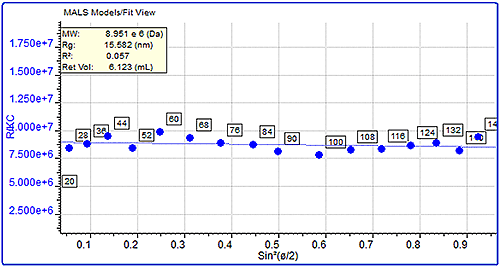
|
여기서는 Viscotek SEC-MALS 20 검출기(또는 다른 모든 Viscotek 검출기)와 Waters Alliance® 시스템을 쉽고 빠르게 연결하고 Malvern의 OmniSEC 소프트웨어를 사용하여 Waters Empower®와 데이터 수집을 동기화하는 것이 가능함을 보였습니다.
이러한 설정을 사용하여 2가지 서로 다른 단백질인 펩신과 트립신 억제 인자의 분자량을 성공적으로 측정하였습니다. 이러한 측정을 통해 두 샘플 내 크기가 큰 응집체에서부터 펩신 샘플의 작은 분해 산물에 이르는 측정 가능한 분자량의 범위를 보여주었습니다.
또한 이들 샘플 내 응집체의 크기 측정도 가능하였습니다. 트립신 억제 인자의 응집체는 상대적으로 크기가 작지만 펩신 응집체는 훨씬 크기가 컸으며 이는 보다 더 개방된 형태의 섬유 조직을 가지고 있을 가능성을 나타냅니다.
이 경우에는 특정 설정을 보여주었지만 이러한 유형의 측정은 Viscotek 고급 검출기를 모든 Waters 또는 기타 제조업체의 모든 SEC 시스템에 연결하여 쉽게 수행할 수 있습니다.