용액 내 단백질의 물리적 특성과 거동은 단백질의 순도 및 제형과 관련된 여러 요소뿐만 아니라 자체가 갖는 고유 특성에 따라 달라집니다. 크기 배제 크로마토그래피(SEC)는 단백질의 복원, 분자량, 응집과 같은 요소를 살펴보는 데 일반적으로 사용하는 강력한 도구입니다.
SEC의 원리는 투과성이면서 불활성인 컬럼 매트릭스를 통과하면서 시료를 분리하는 것과 관련되어 있습니다. 작은 분자는 포어를 더 깊게 통과하고 큰 분자는 제외되므로 컬럼을 더 빠르게 통과합니다. 그 결과는 유체역학적 부피를 기준으로 하는 분리이지만 최종 목적은 일반적으로 분자량을 확인하는 것입니다. 이전에는 분자량을 미지 단백질의 용리 시간을 분자량이 알려진 표준 원형 단백질과 비교하여 분자량을 추정하였습니다. 여기서는 이 방법을 '일반 보정(Conventional Calibration)'이라고 합니다. 이 방법은 자외선(UV) 등의 단일 농도 검출기를 사용하여 수행했습니다. 하지만 이제는 광 산란 검출기와 농도 검출기(UV 또는 굴절률, RI)를 함께 사용하여 머무른 시간과 상관없이 단백질 분자량을 측정할 수 있습니다. 대부분의 단백질은 원형 구조가 아니어서 측정된 분자량이 정확하지 않기 때문에 매우 유용한 기술입니다. 두 번째 농도 검출기, IV(고유 점도), DLS(동적 광 산란) 등의 검출기를 추가할 경우 단일 SEC 측정에서 이용 가능한 정보의 양이 크게 증가합니다.
Malvern Viscotek SEC-MALS 20(그림 1) 시스템은 용리 용적과 상관 없이 단백질 분자량을 측정할 수 있는 20개의 검출각을 갖고 있는 광 산란 장비입니다. 이 응용 노트에서는 SEC를 사용하여 다양한 단백질을 분리합니다. MALS(Multi Angle Light Scattering: 다각도 광 산란) 또는 일반 보정으로 분자량을 측정한 다음 결과의 차이에 대해 논의합니다.
|
농도를 측정하기 위해 TDA RI 검출기를 사용해 SEC-MALS 20 시스템과 Viscotek TDAmax 시스템을 연결하였습니다. 인산염 완충액을 이동상으로 사용하여 2x Viscotek 단백질 컬럼과 함께 시료를 분리했습니다. 모든 단백질 시료는 이동상에서 용리되었습니다. 분자량 특성이 잘 알려진 단백질인 소혈청알부민을 사용하여 SEC-MALS 20 시스템을 보정했습니다. 일련의 원형 단백질을 사용하여 컬럼 보정을 수행했습니다(단백질 분자량 29,000-700,000 Da용 겔 투과 마커 키트, Sigma-Aldrich).
분리를 원활히 진행하고 검출기의 기준선 안정성을 극대화하기 위해 검출기와 컬럼을 모두 30°C에서 보관했습니다.
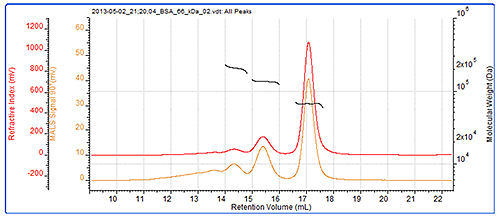
시스템 검증을 위하여 항상 보정을 확인하는 것이 좋으며 BSA 다이머(BSA 시료에 있는 경우가 많음)는 뛰어난 표준 시료입니다. 이 경우 다이머 분자량이 정확하게 측정되었고 시료에 있는 트라이머도 높은 정확도로 측정되었습니다. 그림 2에 BSA 크로마토그램이 나와 있으며 BSA 측정의 결과는 표 1에 나와 있습니다. 그림 2에는 BSA에 대한 SEC-MALS 크로마토그램도 나와 있습니다. 피크 크기와 검출기 응답은 등방성 산란체로서 각 각도에서 동일합니다. 모든 피크에서 분자량이 매우 안정적으로 나타납니다. 이러한 특성은 개별적으로 분자량이 매우 밀접하게 제어되고 단분성의 단백질에서 일반적입니다. 이 크로마토그램과 분자량 값은 이러한 피크가 BSA 올리고머와 다르다는 것을 나타냅니다.
|
|
| 트라이머 | 다이머 | 모노머 | |
|---|---|---|---|
| Peak RV - (ml) | 14.31 | 15.37 | 17.05 |
| Mn - (kDa) | 203.8 | 135.2 | 66.4 |
| Mw - (kDa) | 204.4 | 135.3 | 66.5 |
| Mw/Mn | 1.003 | 1.001 | 1.001 |
| Wt Fr (Peak) | 0.054 | 0.165 | 0.78 |
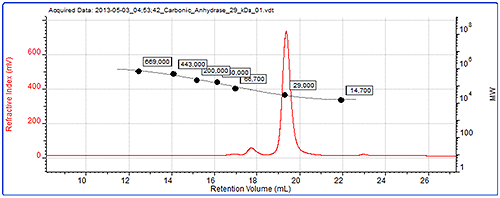
그림 4는 일반 보정의 데이터입니다. 크로마토그램에는 표준 중 하나인 탄산 탈수 효소에 대한 굴절률 신호와 생성된 보정 곡선이 표시됩니다.
|
일반 보정으로 BSA 다이머와 트라이머의 분자량을 측정하고 표 2에 결과를 표시했으며 표 1의 SEC-MALS 데이터와 비교할 수 있습니다. 이러한 올리고머의 구조는 더 이상 모노머와 같이 원형이 아니므로 컬럼 보정을 사용하여 해당 분자량이 정확하게 계산되지 않았습니다. 광 산란이 없을 경우 컬럼 보정을 사용하여 측정한 분자량이 정확한지 여부를 알 수 있는 방법은 없습니다. 따라서 이러한 피크를 트라이머, 펜타머로 잘못 식별할 수 있습니다. 하지만 분자량의 정확한 측정을 통해 광 산란 결과(표 1)를 사용하여 타이머와 트라이머를 정확하게 식별할 수 있습니다.
| 트라이머 | 다이머 | |
|---|---|---|
| Peak RV - (ml) | 14.32 | 15.33 |
| Mn - (kDa) | 341.1 | 198.4 |
| Mw - (kDa) | 345.1 | 202.2 |
| Mw/Mn | 1.012 | 1.019 |
| Wt Fr (Peak) | 0.021 | 0.103 |
마지막으로, SEC-MALS 및 컬럼 보정으로 다른 단백질인 펩신의 분자량을 측정했습니다. 그림 5에 크로마토그램과 광 산란 결과가 나와 있습니다. 표 3은 측정된 분자량의 비교 내용을 보여 줍니다.
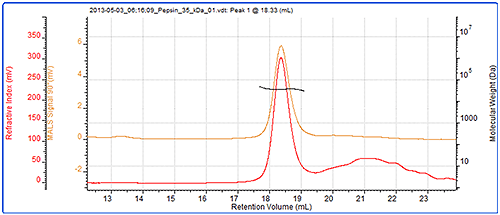
|
| MALS | 컬럼 보정 | |
|---|---|---|
| Peak RV - (ml) | 18.33 | 18.63 |
| Mn - (kDa) | 34.6 | 38.5 |
| Mw - (kDa) | 34.7 | 39.6 |
| Mw/Mn | 1.004 | 1.028 |
펩신의 분자량은 35kDa에서 SEC-MALS로 정확하게 측정되었지만 컬럼 보정을 이용했을 경우 40kDa으로 정확하게 측정되지 않았습니다. 그 이유는 펩신의 구조가 원형이 아니므로 원형 단백질의 경우에 비해 크기 때문입니다 따라서 일반 보정보다 더 빨리 용리되어 분자량이 높게 기록됩니다. 반면, 광 산란으로 측정한 분자량은 보존 체적과 무관하므로 정확하게 측정됩니다.
이 응용 노트는 Malvern SEC-MALS 20 시스템을 사용하여 다양한 단백질의 분자량을 성공적으로 측정하는 방법을 보여 주었습니다. SEC 시스템에 MALS를 추가할 경우 단백질 용리 용적 또는 구조와 상관없이 단백질 분자량을 측정할 수 있습니다. 펩신과 BSA 올리고머는 모두 SEC-MALS 시스템으로 분자량이 정확하게 측정되었습니다.