주입형 바이오 치료약 개발 과정에서는 약의 효능과 환자의 경험이 모두 매우 중요한 매개 변수입니다. 바이오 치료약은 혈장 내 반감기가 짧으므로 활동과 효능을 최대화하기 위해 일반적으로 >100mg/mL 고농도의 정맥 또는 피하를 통해 주입합니다. 환자의 치료 침습성을 최소화하기 위해 적은 주사량이 필요합니다. 이러한 조건에서는 용액 점도의 높은 상승이 관찰되었기 때문에 고농도, 저부피 바이오 제제의 비경구 투여는 문제가 될 수 있습니다.
아르기닌, DMSO(디메틸 술폭시드)[1], 소수성 염[2] 등의 저분자 첨가물을 첨가할 경우 응집망의 형성을 방해하여 고농도 단백질 용액의 점도가 감소하는 것으로 알려져 있습니다. 개발 초기 단계에서 저점도 특성을 유지하거나 정의된 점도 임계값을 초과하지 않도록 하는 제형 검사가 가능할 경우 주사와 주입이 향상된 바이오 치료약 후보를 선택할 수 있습니다. 이러한 선택 프로세스는 바이오 치료약을 시장에 더 빠르게 비용 효율적으로 출시할 수 있는 경로를 제공합니다.

|
Viscosizer 200은 매우 적은량의 시료에서 자동 점도 측정을 수행하는 벤치톱 시스템입니다(그림 1). 이 응용 노트에서는 Viscosizer 200을 사용하여 첨가물이 단백질 제제의 점도에 미치는 영향을 조사합니다.
약 400mg/mL 소혈청알부민(BSA; Sigma Aldrich, 영국 풀) 스톡 용액을 두 개의 다른 버퍼, (1) 30mM 히스티딘, pH 5.3과 (2) 30mM 히스티딘, 200mM 아르기닌, HCl pH 5.3으로 전처리했습니다. 각각의 스톡 용액을 여러 농도로 희석하여 준비하고 UV 스펙트로스코피를 이용하여 280nm에서 E1%를 통해 새로운 제형의 BSA 농도를 확인하였습니다(Nanodrop 200, Thermo Scientific, 미국 윌밍턴). 이 시료는 추가 전처리를 거치지 않았습니다. 100µL의 시료를 작은 바이얼로 옮기고 20oC의 오토샘플러 캐러셀에 배치했습니다. 그런 다음 점도 측정을 위해 1000mbar에서 시료를 코팅되지 않은 용융 실리카 미세모세관에 로드하고 214nm에서 두 탐지 윈도우 간 시료 전단의 진행 상태를 모니터링했습니다. 측정 사이에 30mM 히스티딘 버퍼로 모세관을 세척하고 2000mbar에서 순수로 세척하였습니다.
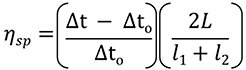
|
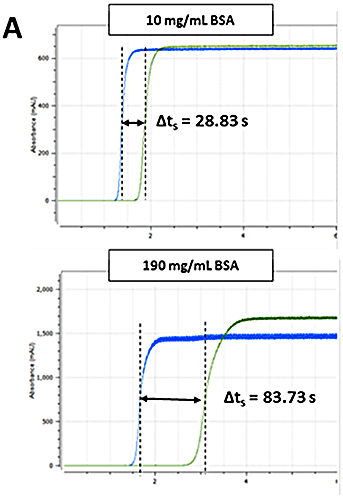
자동 샘플러 제어, 데이터 획득, 데이터 처리에 Viscosizer 200 소프트웨어(영국 Malvern Instruments Ltd.)를 사용했습니다. 방정식 1의 관계를 사용하여 각 제제에 대해 ηsp를 결정했습니다. 점도 추적의 전단 분석(그림 2A)을 사용하여 시료와 점도 표준 물질(순수, 1.0021 cP)에 대해 각각 Δt 및 Δt0을 구했습니다. 나머지 매개 변수인 L, l1, l2는 모세관 길이입니다.
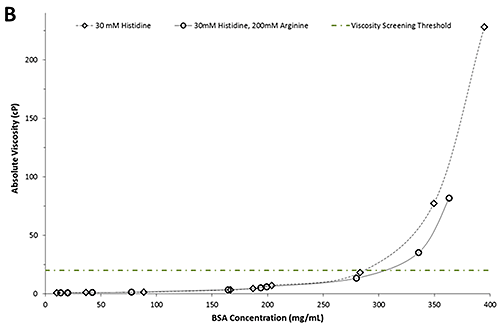
그림 2B는 BSA 농도의 함수로 표시된 절대 점도의 도표입니다. 예상대로, 절대 점도는 두 제제의 농도가 증가함에 따라 증가합니다. 녹색 점선/파선은 후보 선택을 위한 일반적 점도 검사 임계값을 나타냅니다.
|
|
절대 점도를 비교했을 때 250mg/mL 미만 농도에서는 두 버퍼에서 제제 간 차이가 거의 없는 것으로 나타났습니다. 하지만, 250mg/mL를 초과하는 농도의 경우 30mM 히스티딘에 들어 있는 BSA 제제는 아르기닌이 포함된 BSA 제제보다 점도가 훨씬 높은 것으로 나타났습니다. 예를 들어, 20cP에서 아르기닌을 포함한 BSA 제제는 히스티딘만 있는 버퍼의 BSA 제제보다 약 30mg/mL 더 농도가 높습니다. 아르기닌의 명백한 점도 강하 기능은 단일 클론 항체에서 수행한 연구와 일치합니다[1, 3]. 중요한 것은 이 정보를 사용하여 저점도 특성을 기준으로 제제 후보를 선택할 수 있다는 점입니다. 위의 결과를 바탕으로 4가지 제제가 20cP 점도 검사 임계값을 초과하여 결과적으로 추가 개발에서 제외됩니다.
의료에 생체 물질을 결합할 경우 약품 개발 및 제조 프로세스의 복잡성이 가중됩니다. 고농도, 저점도 바이오 치료제 제제의 생산은 오늘날 의약품 산업이 직면한 주요 과제 중 하나입니다. 이 응용 노트에서는 Viscosizer 200를 이용하여 다른 단백질 제제의 점도 간 차이를 구분하고 정의된 점도 임계값을 충족하는 적절한 제제 후보자를 검사하는 도구로서 이 기술을 구현할 수 있는 방법에 대해 설명했습니다. 그러므로 향후 개발 시 문제가 있는 후보 분자를 초기 단계에서 제외하여 시간과 투자 비용을 크게 절감할 수 있습니다.