
Linha MicroCal ITC
Determina os parâmetros de ligação das biomoléculas em uma única análise
Medição sem identificação da afinidade de ligação e termodinâmica de interações biomoleculares para entender a função e os mecanismos em um nível molecular
A Calorimetria de titulação isotérmica (ITC) é uma técnica de quantificação sem identificação usada nos estudos de uma ampla variedade de interações biomoleculares. Funciona pela medição direta do calor que é liberado ou absorvido durante um evento de ligação biomolecular.

Determina os parâmetros de ligação das biomoléculas em uma única análise
A ITC é a única técnica que pode determinar simultaneamente todos os parâmetros de ligação em um único experimento. Exigindo nenhuma modificação dos parceiros de ligação, que com identificações fluorescentes ou por meio de imobilização, a ITC mede a afinidade de parceiros de ligação em seus estados nativos.
Medir a transferência de calor durante a ligação permite a determinação precisa de constantes de ligação (KD), estequiometria de reação (n), entalpia (∆H) e entropia (ΔS). Isso fornece um perfil termodinâmico completo da interação molecular. A ITC vai além das afinidades de ligação e pode elucidar os mecanismos subjacentes às interações moleculares. Esse entendimento mais profundo das relações de função de estrutura permite uma tomada de decisão mais segura na seleção de hit e otimização de chumbo.
A Calorimetria de titulação isotérmica é usada para medir reações entre biomoléculas. A metodologia permite a determinação de afinidade de ligação, estequiometria e entropia e entalpia da reação de ligações na solução, sem a necessidade de usar identificações.
Quando ocorre a ligação, o calor é absorvido ou liberado, e isso é medido pelo calorímetro sensível durante a titulação gradual do ligante na célula de amostra que contém a biomolécula de interesse.

No microcalorímetro, há duas células, uma que contém água e age como uma célula de referência e a outra que contém a amostra. O microcalorímetro precisa manter essas duas células exatamente na mesma temperatura. Os dispositivos de percepção de calor detectam a diferença de temperatura entre as células quando ocorre a ligação e dão retorno aos aquecedores, que compensam essa diferença e retornam as células para temperaturas iguais.
A célula de referência e a célula de amostra são definidas para a temperatura experimental desejada. O ligante é carregado em uma seringa que se encaixa em um dispositivo de injeção muito preciso. O dispositivo de injeção é inserido na célula de amostra que contém a proteína de interesse. Uma série de pequenas alíquotas de ligantes é injetada na solução de proteínas. Se houver um ligante para a proteína, as mudanças de calor de alguns milhões de um grau Celsius são detectadas e medidas.
Assim que é feita a primeira injeção, o microcalorímetro mede todo o calor liberado até que a reação de ligação atinja o equilíbrio. A quantidade de calor medido está na proporção direta em relação ao valor do ligante.
No exemplo abaixo, a reação é exotérmica, o que significa que a célula de amostra se torna mais quente do que a célula de referência e causa um pico de queda no sinal. À medida que a temperatura de duas células se torna igual, o sinal retorna para sua posição inicial. A segunda menor alíquota do ligante é injetada na célula de amostra e novamente o microcalorímetro compensa a pequena alteração de calor detectada.
A proporção molar entre o ligante e a proteína aumenta gradualmente por meio de uma série de injeções de ligantes. A proteína fica cada vez mais saturada, ocorre menos ligação do ligante e a mudança de calor começa a diminuir até que finalmente a célula de amostra contenha um excesso de ligante versus proteína, levando a reação à saturação.

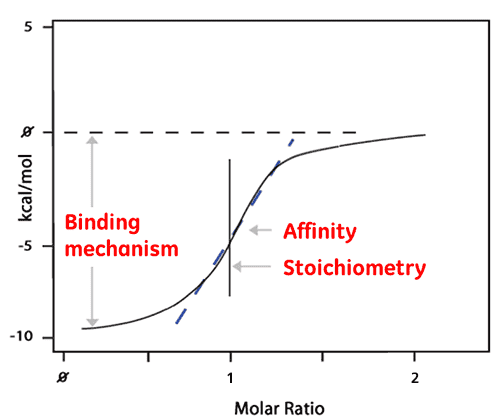
A área de cada pico é então integrada e plotada em relação à proporção molar do ligante com a proteína. A curva isotérmica resultante pode ser ajustada a um modelo de ligação a partir do qual a afinidade (KD) é derivada. A proporção molar no centro da curva isotérmica de ligação nos dá a estequiometria de reação. O gráfico abaixo é um exemplo de uma reação de ligação 1:1.
A entalpia (ΔH) também é derivada diretamente da curva isotérmica e da quantidade de calor liberada por Mole de ligação de ligante. Isso significa que um único experimento de ITC fornece uma riqueza de informações sobre a reação de ligação que ajuda a entender a natureza da interação e a explorar os acionadores termodinâmicos.
A ITC é amplamente usada na descoberta e no desenvolvimento de medicamentos para:

PEAQ-ITCMedição de alta sensibilidade de todos os parâmetros de ligação |

MicroCal PEAQ-ITC AutomatedMedição de alta produtividade de vários parâmetros de ligação. |
|
|---|---|---|
| Tipo de medição | ||
| Análises Livre de Marcadores | ||
| Afinidade de ligação | ||
| Tecnologia | ||
| Calorimetria de titulação isotérmica (ITC) | ||
| processamento de amostra | ||