Comparaison entre l'interférométrie biocouche (BLI), la résonance plasmonique de surface (SPR) et l'interférométrie couplée à un réseau (GCI)

Comprendre l'interaction entre les molécules, en particulier la cinétique, permet de répondre à de nombreuses questions. Il n'est donc pas surprenant qu'elle doive être analysée dans de nombreux domaines de recherche.
Par exemple, vous pourriez avoir besoin de savoir comment une molécule interagit avec un récepteur pour comprendre comment la signalisation se produit dans un organisme. Vous pourriez aussi chercher à savoir si un médicament se lie à un composé particulier et à quel point, dans le cadre de la découverte de médicaments. L'affinité de liaison peut répondre à cette question, mais la mesure de la cinétique de liaison permet d'obtenir plus de détails.
Les applications dans lesquelles la cinétique de liaison est utile sont aussi vastes que les technologies, et plusieurs d'entre elles peuvent être utilisées pour les étudier. Ici, nous en comparons trois.
Remarque : pour plus d'informations sur la mesure des interactions, la thermodynamique et autres, veuillez consulter notre page sur la technologie ITC.
![[label free 2.png] label free 2.png](https://dam.malvernpanalytical.com/f38155b2-4fa2-4ed4-8366-ae6000effacd/label%20free%202_Original%20file.png)
L'interférométrie biocouche (BLI) est une technologie optique, basée sur la surface et sans marquage. Contrairement à d'autres technologies de biocapteurs, la technologie BLI ne fonctionne pas avec un flux microfluidique, mais par immersion des pointes des capteurs dans l'échantillon/le tampon. La lumière réfléchie par la pointe d'une fibre optique présente un déphasage qui dépend de l'indice de réfraction à proximité de la surface de la pointe. La lumière réfléchie interfère avec la lumière réfléchie par une surface de référence interne.
En utilisant la lumière blanche comme source, un schéma d'interférence spectrale est enregistré et comprend des informations sur l'indice de réfraction près de la surface de la pointe. Lorsque les biomolécules se lient à la surface de la biocouche immergée dans la solution expérimentale (un échantillon, par exemple), le profil de l'indice de réfraction et donc le schéma spectral changent.
La résonance plasmonique de surface (SPR) est une autre méthode d'analyse optique, sans marquage. Il s'agit de l'une des premières technologies sans marquage basées sur la surface. Elle détecte les variations de l'indice de réfraction causées par les interactions moléculaires dans un champ évanescent à proximité de la surface d'un capteur.
Dans ces capteurs, un film métallique sur un support en verre est éclairé par une lumière d'une longueur d'onde spécifique. À un angle précis, en fonction de l'indice de réfraction à proximité de la surface, les plasmons de surface sont activés. Comme cette énergie manque dans le faisceau lumineux réfléchi, un creux d'intensité se forme lors de la projection sur le capteur.
En déterminant la position du creux en temps réel, la technologie SPR mesure les variations de l'indice de réfraction sur la surface métallique. Les solutions contenant l'analyte sont injectées à l'aide de microcanaux, et au moins une cellule de circulation de référence est utilisée pour éliminer les effets volumiques.
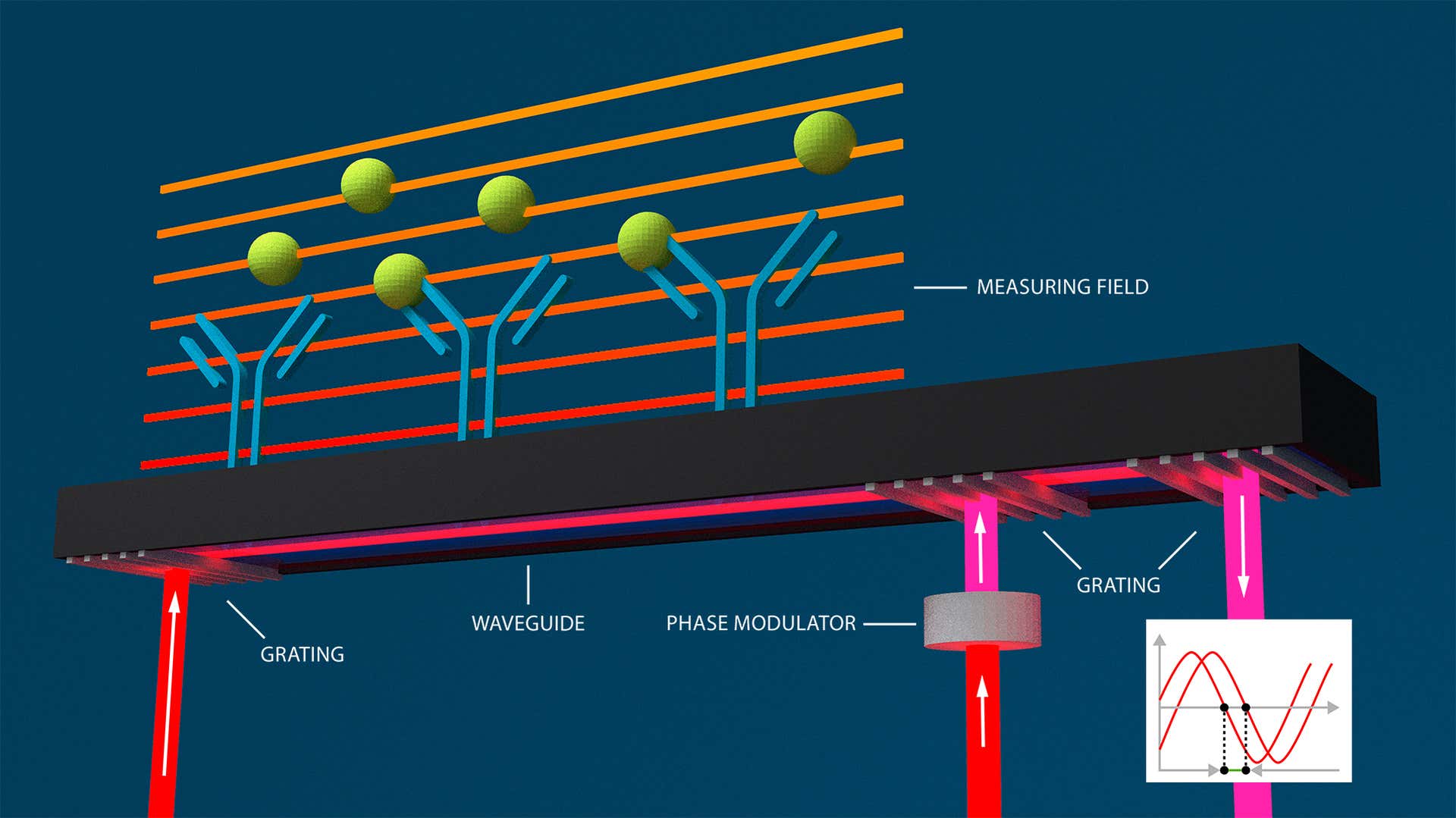
Basée sur l'interférométrie à guide d'ondes (autre méthode optique sans marquage), l'interférométrie couplée à un réseau (GCI) peut surveiller et caractériser les interactions moléculaires en temps réel, en déterminant les paramètres de vitesse cinétique, les constantes d'affinité et les concentrations des molécules d'analyte qui interagissent avec un ligand immobilisé.
Dans l'interférométrie à guide d'ondes, les variations de l'indice de réfraction sont mesurées dans le champ évanescent d'un guide d'ondes à proximité de la surface d'un capteur. Ces variations entraînent également un changement de la phase lumineuse. La lumière traverse le guide d'ondes, créant ainsi une onde évanescente qui s'étend sur toute la longueur de la surface du capteur. Les changements de phase sont affichés par interférométrie. La technologie GCI de Creoptix reprend les avantages de l'interférométrie à guide d'ondes et élimine les problèmes classiques d'alignement :
![[GCI_CX_weblandscape.jpg] GCI_CX_weblandscape.jpg](https://dam.malvernpanalytical.com/b266ecf3-637f-41d5-a36a-ae29010df43c/GCI_CX_weblandscape_Original%20file.jpg)
La meilleure technique d'interaction biomoléculaire dépend de l'application et des objectifs de l'utilisateur. Ci-dessous, vous trouverez une comparaison de ces trois techniques concernant quatre exigences clés : une large gamme d'applications, la mesure des liens les plus faibles, la mesure des liens les plus serrés et une maintenance réduite du système.
| Interférométrie couplée à un réseau (GCI) | Résonance plasmonique de surface (SPR) | Interférométrie biocouche (BLI) | |
|---|---|---|---|
| Gamme d'applications plus large Adaptée à une variété de molécules allant de poids moléculaires faibles à élevés, purifiées ou brutes. | Oui Adaptée aux fragments, petites molécules, peptides, protéines, virus, surnageants de cultures cellulaires, sérums, lysats cellulaires | Non Adaptée aux petites molécules, peptides (compatibilité limitée pour les fragments, virus, surnageants de cultures cellulaires, sérums et lysats cellulaires) | Non Adaptée aux surnageants de cultures cellulaires, sérums et lysats cellulaires (compatibilité limitée pour les peptides, protéines et virus) |
| Mesure des liens les plus faibles Capacité à mesurer la cinétique avec des taux de dissociation rapides grâce à une vitesse fluidique accrue et des taux d'acquisition élevés. | Oui Taux de dissociation jusqu'à kd = 10 s-1 | Non Taux de dissociation jusqu'à kd = 1 s-1 | Non Taux de dissociation jusqu'à kd = 0,1 s-1 |
| Mesure des liens les plus serrés Capacité à mesurer avec précision la cinétique, même pour les liens serrés et les taux d'association rapides. | Oui Mesure dans des conditions d'écoulement | Oui Mesure dans des conditions d'écoulement | Non Mesure dans des conditions de diffusion limitée (pas de microfluidique) |
| Maintenance réduite du système Temps d'arrêt minime du système pour l'entretien ou les réparations imprévues. | Oui Microfluidique sans obstruction | Non Microfluidique traditionnelle | Oui Pas de microfluidique |