바이오 약제 단백질의 안정성은 실현 가능한 약물 개발의 성패를 가름하는 결정적인 요소입니다. 단백질의 안정성은 생산, 제조, 포뮬레이션, 장기 보관, 환자에 대한 전달 및 효능에 있어 중요한 역할을 합니다. 높은 안정성을 가진 단백질은 제조 공정 중에 문제가 발생할 가능성이 더 낮고, 생산의 경제성이 더 높고, 포뮬레이션 및 보관 중에 화학적 변화나 응집 없이 기능을 유지할 가능성이 더 높습니다. 바이오 제약 개발에 대한 “설계에 의한 품질”(Quality by Design, QbD) 접근법에서 안정성 특성 분석은 후보 분자의 “개발 가능성” 및 “약물화 가능성”을 평가하는 데는 물론 공정 개발 및 제조 중에도 지속적으로 활용됩니다. 안정성 데이터는 또한 제조 지원, 바이오 제약 비교성 및 생물학적 동등성 평가에 사용되는 고차원 구조(HOS) 특성 분석 및 “지문 분석”에도 활용됩니다. 더불어 단백질 HOS 특성 분석은 새로운 바이오 약제 및 바이오 시밀러에 대한 규제 제출물에 있어 “예측 결과”가 됩니다.
단백질의 복잡한 속성으로 인해 생물물리학적 특성 분석 도구는 바이오 약품의 완벽한 특성 분석에 있어 중요합니다. 원이색법(CD), 동적 및 정적 광산란(DLS 및 SLS), 크기 배제 크로마토그래피 다각도 광산란(SEC-MALS), 푸리에 변환 적외선 분광법(FTIR), 분석적 한외 여과(AUC), 크기 배제 크로마토그래피(SEC), 시차 주사 형광측정법(DSF), 고유 형광측정법(IF) 및 시차 주사 열량측정법(DSC)와 같이 단백질 안정성을 평가하는 데 흔히 사용되는 몇가지 생물물리학적 도구들이 있습니다.
이러한 생물물리학 분석법은 모두 바이오 제약 개발에 있어 중요한 역할을 하며 DSC에 의한 열적 안정성의 특성 분석은 필수적입니다. 단일클론 항체 고차원 구조 특성 분석을 위한 생물물리학 기술에 관한 2015년 논문, Gokarn 외 언급 내용: “DSC는 주어진 완충액 조건에서 단백질의 안정성을 평가하기 위한 최고의 기법으로 유지되고 있습니다”[1].
본 백서의 목적은 개발 단계로 진행할 약물 후보 물질의 선정 과정에서 단백질 바이오 약제(주로 항체)의 특성을 분석하는 데 있어 DSC가 어떻게 활용되고 있는지를 설명하는 것입니다.
DSC는 미세 열량측정 기법으로서 단백질, 핵산, 지질 및 기타 바이오 고분자의 열적, 구조적 안정성을 분석하는 데 사용됩니다[2-7]. DSC는 온도의 함수로서 열용량을 측정합니다. 본 백서에서 설명된 단백질 특성 분석에 사용되는 DSC 장비는 ‘배율 보상’ 장비로서 고정된 샘플 셀에 바이오 고분자 용액을 배치하고, 대응되는 기준 셀 내에 상응하는 완충액을 배치하여 분석을 수행합니다. 샘플 셀에서 얻은 열 용량(Cp) 신호는 기준 셀의 신호와 비교됩니다. 셀의 온도가 증가함에 따라 기준 셀과 샘플 셀 사이의 온도 차이가 지속적으로 측정되고 배율 단위로 보정됩니다. DSC는 단백질을 증가하는 온도에 노출시켜 단백질의 풀림이 시작되면 그에 따른 단백질의 Cp 증가를 측정하기 때문에 ‘강제 분해 분석법’이라 할 수 있습니다(그림 1).
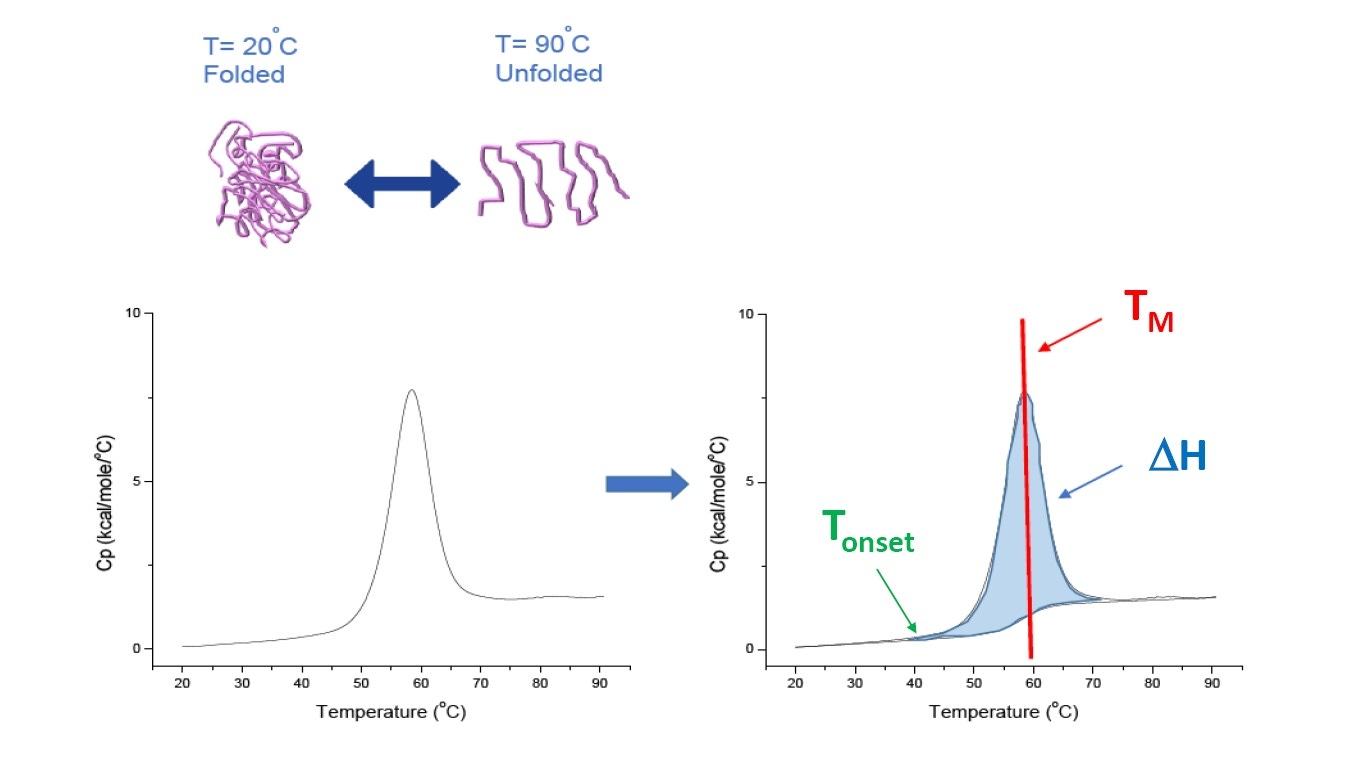
그림 1: DSC의 작동 방식. 단백질의 열적 변성에 따른 열용량(Cp) 변화. DSC 실험은 단백질이 주로 네이티브 형태에서 접힌 상태인 온도에서 시작합니다. 온도가 증가함에 따라 어느 순간 단백질의 풀림/변성(Tonset)이 시작되고 Cp가 증가합니다. 단백질 중 50%가 네이티브 형태이고 50%가 변성되는 온도에서 Cp는 최대값에 도달합니다. 이를 열전이 중간점 또는 TM이라 합니다. TM 이상에서는 단백질이 주로 변성된 상태이며 DSC 실험의 말미에는 모든 단백질이 풀린 형태가 됩니다. DSC의 실험 변수에는 Tonset, TM, 풀림 엔탈피(ΔH)가 있습니다.
DSC는 형광 물질이나 기타 표지 또는 프로브 없이 열용량 변화를 직접 측정합니다. 용융 또는 변성 온도라고도 하는 열전이 중간점(TM)은 단백질의 50%가 네이티브(접힘) 형태이고 50%는 변성된 형태가 되는 온도를 말합니다. TM은 DSC 서모그램에서 “피크”로 나타납니다(그림 1).
TM은 우수한 열적 안정성 지표로 여겨집니다. 즉, TM이 높을수록 단백질이 열적으로 더욱 안정적인 것입니다. 여러 영역 단백질(항체 등)은 일반적으로 DSC 서모그램에서 하나 이상의 피크를 가지므로 하나 이상의 TM을 측정할 수 있습니다(예시로 그림 2 참고).
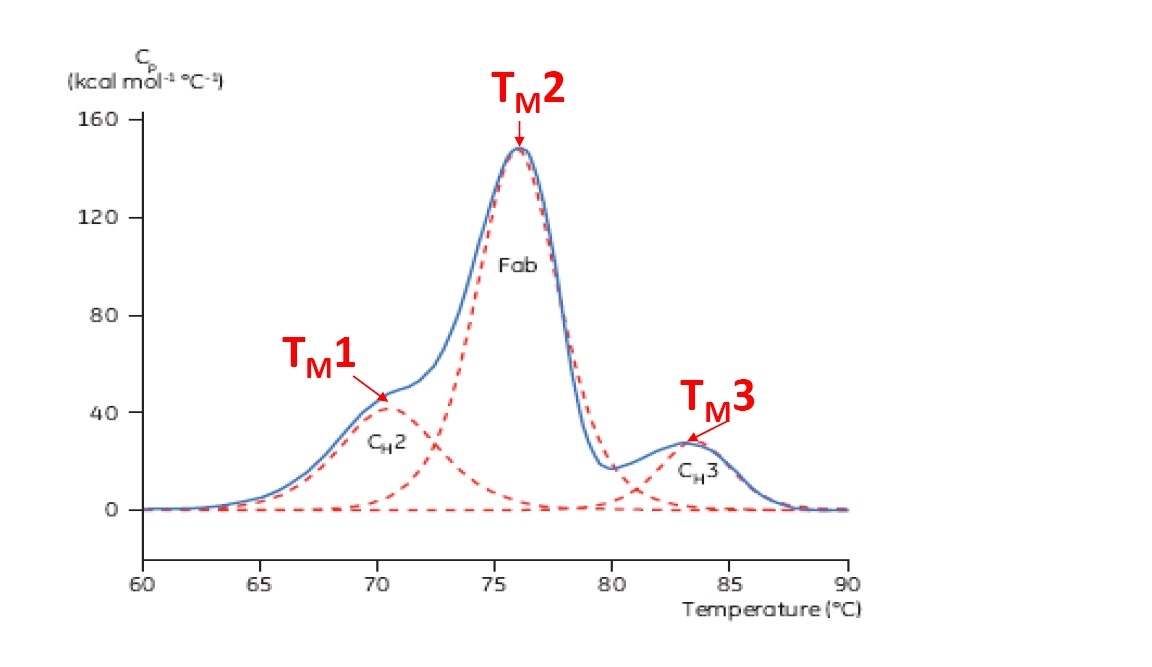
그림 2: CH2, Fab, CH3 영역을 식별한 단일클론 항체의 대표적 DSC 서모그램. 빨간색 점선은 각 영역 전이의 디콘볼루션 피크로 3개의 TM이 표시되어 있습니다.
DSC는 단백질 안정성의 특성을 분석하고 순위를 분석하는 데 사용할 수 있는 풀림 엔탈피(ΔH, 곡선 아래의 면적으로 측정)와 같은 다른 유용한 매개 변수를 제공합니다. 단백질 풀림은 단백질을 접힌 상태로 유지하는 2차 비공유 결합을 파괴하는 데 에너지 입력이 필요하기 때문에 흡열 과정입니다. DSC는 또한 Tonset(풀림 시작), ΔCp(풀림의 열용량 변화), T1/2(1/2 피크 높이에서의 너비, 풀림 서모그램의 형태를 나타냄)도 측정합니다. DSC 분석은 이러한 매개 변수 조합에 대한 측정을 포함할 수 있습니다.
Malvern Instruments는 용액 내 단백질 및 바이오 고분자에 대한 TM 선별 및 열역학적 특성 분석을 위해 설계된 자동 DSC인 MicroCal VP-Capillary DSC 시스템[8,9]을 제공합니다.
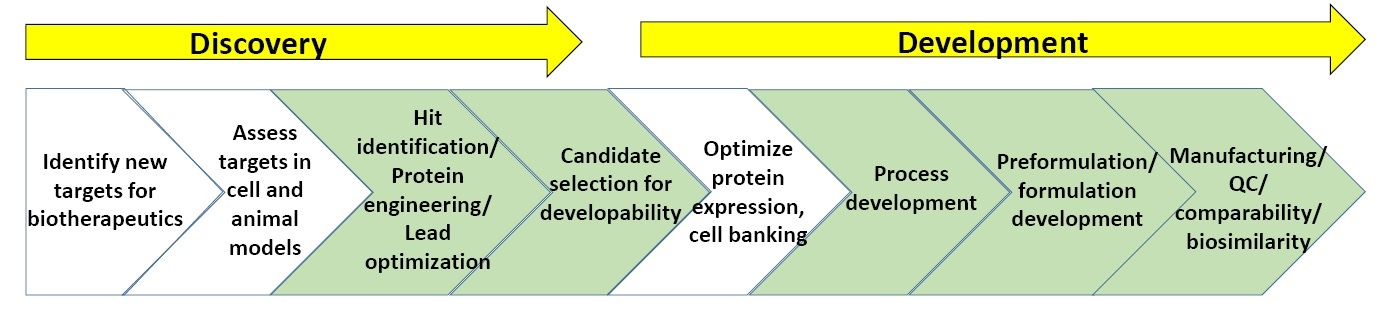
그림 3: 바이오 제약 발견 및 개발 과정의 일반적인 체계
그림 3은 바이오 제약 발견 및 개발에 수반되는 특성 분석 과정의 일반적인 체계를 보여주고 있습니다. 녹색 부분은 안정성 분석 등의 생물물리학 특성 분석이 가장 흔하게 이용되는 부분을 나타냅니다. 본 백서의 끝에는 바이오 제약의 발견 및 개발에 대한 “권장 읽을거리” 목록이 있습니다.
아미노산 배열, 즉 일차(1°) 구조는 폴리펩티드 사슬과 단백질 구조에서 가장 기본적인 구성 요소입니다. 여기서 중요한 것은 고차원 구조(HOS)라고도 하는 단백질의 3차원 구조를 이해하고 분석하는 것입니다. 단백질 HOS에는 3가지 수준이 있습니다. 이차(2°) 구조는 α 나선, β-면, 회전형 및 불규칙 나사선 등 단백질 1차 구조의 국부적인 접힘 구조를 말합니다. 3차(3°) 구조는 2차 구조 요소의 배열에서 발생하는 단백질의 최종적인 3차원 구조를 말합니다. 4차(4°) 구조는 2개 이상의 동일하거나 서로 다른 폴리펩티드 사슬의 상호 작용으로 인해 발생하는 구조를 설명합니다.
과학자들은 원하는 바이오 약제를 만들기 위해 후보 물질을 선정할 때 이미 높은 안정성이 입증된 바이오 분자를 먼저 살펴본 다음 단백질 엔지니어링을 통해 안정성을 높여야 한다는 결론을 이끌어 낼 수 있습니다. 정제 중에 단백질은 보통 안정적이고, 정확히 접혀 있고 활성인 상태에서 제거되므로 올바른 완충액, 첨가제, 정제 방법 및 보관 조건을 사용하여 이 과정에서 단백질을 가능한 한 안정적으로 유지하는 것이 중요합니다.
단백질 분자는 바이오 약제 생산 및 포뮬레이션 과정에서 빈번히 발생하는 열, 화학물질, pH 변화, 압력, 혼합, 고농도와 같은 스트레스 요인에 노출되면 단백질 구조가 변성된(풀린) 단백질이 되기 쉽습니다. 포뮬레이션된 피하(SC) 단백질 약물은 안정적이며 적합한 용기(바이알 또는 프리필드 주사기 등)에 밀봉해 놓으면 아주 높은 단백질 농도(100mg/mL 이상)인 경우에도 일반적으로 수년 동안 영향을 받지 않습니다. 용액 내 단백질도 변성된 비활성 단백질로 이어질 수 있는 탈아미드화 및 산화와 같은 화학적 변화에 영향을 받기 쉽습니다.
단백질 바이오 약제의 경우 변성 또는 기타 화학적 변화로 인해 응집물이 형성되면 제품의 효능이 감소하거나 약물로서 기능이 떨어질 수 있습니다. 더욱 중요한 점은 단백질 응집이 환자에게 나타나는 잠재적으로 치명적인 면역원성 반응과 관련되어 왔다는 것입니다. 안정적인 단백질 약물을 사용하면 더욱 경제적인 생산이 가능하며 더욱 성공적이고 안전하고 효과적인 약품을 얻을 수 있습니다.
DSC는 분자의 형태 안정성과 함께 단백질이 열적으로 변성될 때 발생하는 3차 및 4차 구조의 변화에 대한 측정은 물론 내재적, 외부적 요인이 단백질 안정성에 미치는 영향에 대한 정보를 제공합니다. DSC는 장기 안정성에 대한 예측 인자로서 바이오 제약 단백질의 특성 분석에 사용되는 가장 완전한 최고의 정량적 열적 안정성 분석으로 평가되고 있습니다[1,10-14]. DSC의 T M은 후보 물질 선정(개발 가능성), 포뮬레이션 선별, 공정 개발에서 안정성의 순위를 분석하는 데 흔히 사용되는 매개 변수입니다. 단백질의 안정성이 높을수록 TM도 높습니다. DSC의 엔탈피(∆H), T onset, T1/2, ∆Cp는 안정성 순위 결정, DSC 데이터 검증, 단백질 풀림의 정량 분석, 고차원 구조 ‘지문 분석’에도 사용됩니다[10-14].
정의된 용액 조건에서의 단백질 DSC 분석은 분석되는 단백질이 같거나 매우 유사한 경우 재현 가능하며 정량적입니다(그림 4). 즉, DSC 서모그램이 재현 가능한 프로필을 가지며 매개 변수(TM, ∆H, Tonset 등)가 허용 범위 내에 있게 됩니다[12-14]. 서모그램이 다르고 DSC 피팅 매개 변수가 변하는 경우 이는 단백질 잘못 접힘, 분해, 응집, 용매의 차이, 전사 이후 수정의 변화와 같은 사건이 있었거나 단백질의 구조적 안정성에 변화를 일으키는 기타 고차원 구조 차이가 있다는 것을 의미합니다.
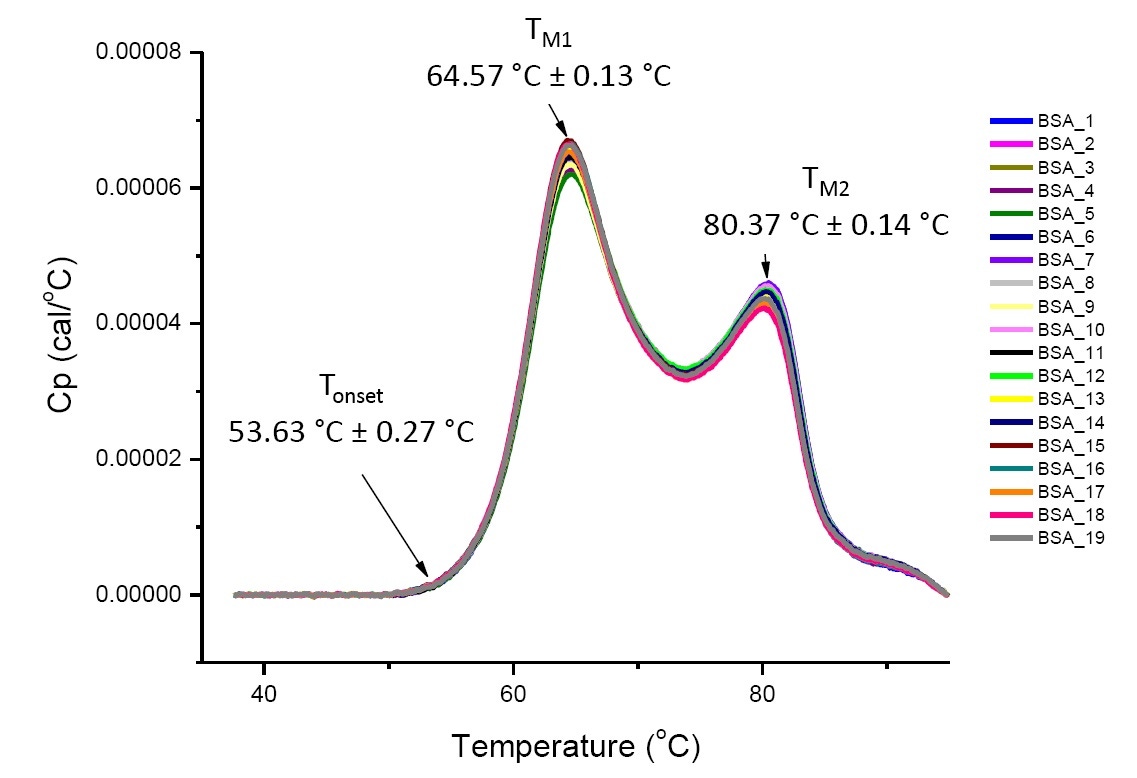
Figure 4 PBS의 소 혈청 알부민에 대한 19개 DSC 서모그램(Sigma A1933, 크로마토그래피 방식으로 정제). 주사 속도 정규화, 완충액 대 완충액 제거, 통합 기준선 제거 후 표시된 DSC 데이터. Tonset, TM1, TM2의 평균과 표준편차가 표시되어 있습니다.
DSC는 재현 가능하고 정량적인 데이터를 제공하기 때문에 제조 중 제품 평가(배치 대 배치 및 현장 대 현장 비교 등), 단백질 변이형 및 수정 제품의 비교(글리코실화, 탈아미드화, 산화 등), 생물학적 동등성을 위한 귀중한 HOS 분석 도구입니다. DSC 데이터는 또한 신약 및 바이오 시밀러 관련 제출물에서 HOS 특성 분석으로서 규제 근거 문서로도 사용됩니다. 바이오 제약 산업의 과학자에 대한 설문조사에서 DSC는 후보 물질 선정, 포뮬레이션 개발, 제품 특성 분석, 비교성, 생물학적 동등성 연구를 수행할 때 ‘아주 유용한’ 또는 ‘몹시 유용한’ HOS 생물물리학 도구로 평가되었습니다[15].
항체와 같은 여러 영역 단백질의 경우 DSC 서모그램은 하나 이상의 풀림 전이를 갖습니다(그림 2). DSC는 여러 영역을 분석하고 정량화할 수 있으며 두세 개 이상의 전이에 대해 TM을 측정할 수 있습니다. 서모그램의 피크에서 얻어지는 TM 값은 복잡한 데이터 분석 없이 DSC 데이터에서 간단히 측정할 수 있습니다. TM을 측정할 수 있는 CD, IF, DSF와 같은 기타 생물물리학 분석법은 가장 낮은 온도에서 발생하는 첫 번째 TM만 검출할 수 있거나 여러 영역 단백질에서 가장 “주된” TM만 검출할 수 있습니다. 분광법 또는 형광측정법 데이터에서 하나 이상의 TM을 추출하려면 복잡한 데이터 피팅이 요구되며 재현이 불가능할 수 있습니다.
DSC는 다른 TM 선별 분석법과 비교하여 더 많은 주사당 단백질 샘플이 필요하며 처리량이 낮을 수 있습니다. 샘플이 제한된 경우 한가지 옵션은 DSF 또는 IF로 초기 TM 순위 분석을 수행한 다음 몇 개의 샘플을 선택해 DSC로 TM을 검증하는 것입니다. 안정성 분석에서 TM을 얻기 위해 형광측정법이나 분광법만을 사용하는 것보다 DSC로 TM 결과를 검증하는 것이 중요합니다. 형광 기반 분석법은 출력 데이터와 간섭을 일으키는 아티팩트(artifact)가 있을 수 있고, 이러한 아티팩트 때문에 TM 결과가 더 높거나 낮게 이동할 가능성이 있습니다. 일부 단백질 및 완충액 조건은 형광측정법에 적합하지 않으며 그러한 방법으로 TM의 차이를 검출하지 못할 수 있습니다. 결론적으로 형광측정법과 분광법은 DSC와 달리 열량 측정 엔탈피와 기타 열역학 매개 변수를 측정하지 못합니다.
DSC는 다음과 같은 이유로 바이오 제약 산업에서 ‘절대적 표준’의 열적 안정성 분석법으로 여겨지고 있습니다.
바이오 제약의 발견 및 개발에 DSC 데이터가 어떻게 사용되는지에 대한 예시는 본 백서와 다른 Malvern 백서 및 응용 노트, 인용된 간행물에서 찾을 수 있습니다.
단백질 바이오 약제를 식별하는 연구 단계에서 초기의 주안점은 약물과 잠재적인 상호 작용이 기대되는 대상을 발견하는 데 있습니다. 일단 잠재적인 대상을 파악한 후 처음으로 수행할 작업은 이러한 대상과 상호 작용을 일으켜 질병 상태를 감소시키거나 제거하는 유리한 임상 결과로 이어질 수 있는 바람직한 생물학적 효과를 유도하는 약물을 찾는 것입니다. 하나 이상의 약물 후보 물질을 파악한 후에는 이러한 바이오 약제 후보 물질의 “개발 가능성”을 평가하는 것입니다.
단백질 약물의 개발 가능성과 단백질의 생물물리학적 특성을 평가하는 목적은 세포 배양 생산, 정제, 포뮬레이션, 포장, 배송, 장기 보관 중에 발생할 수 있는 스트레스를 어떠한 단백질이 잘 견딜 수 있는지(즉, 안정성)를 예측하기 위한 것입니다. 이때 다음과 같은 사항을 이해하는 것이 중요합니다.
‘발견’이 끝나면 임상전 개발을 시작하기 전에 단백질 약물 후보 물질에 대한 개발 가능성 분석을 수행하는 것이 중요합니다. 선도적 후보 물질이 선정되고 생산을 위한 확장이 시작된 후 약물이나 공정을 변경하게 되면 비용이 증가하고 프로젝트가 중단될 가능성이 높아지기 때문입니다. 초기 시점에 올바른 선택을 하게 되면 실패할 확률이 줄어들고 제약 회사의 비용이 크게 감소하는 것은 물론 경제적인 약물 생산이 가능해집니다.
발견 후기/개발 초기의 이 시점에는 생물물리학 분석에 이용할 수 있는 정제된 단백질의 양이 제한적이거나 개발 가능성 분석법 평가를 위한 시간이 제한된 경우가 많습니다. 형광측정법, 광산란, 크기 배제 크로마토그래피와 같은 생물물리학적 방법과 DSC가 모두 이 시점에 공통적으로 사용됩니다. 질량분광법(HDX-MS)을 통한 수소-중수소 교환 및 초원심분리와 같은 기타 분석법도 유용한 정보를 제공합니다.
DSC를 이용해 단백질 약물에 대한 간단한 프로파일링을 초기에 수행하여 TM 값의 순위를 분석하며 후보 약물을 비교하여 최적의 안정성을 가진 단백질을 찾고, 장기 안정성을 예측하고, 열적 안정성이 떨어지는 구조를 가진 분자를 배제하는 데 아주 유용할 수 있습니다. 가장 낮은 TM 값을 가진 단백질은 온도의 작용에 따른 불안정성으로 인해 후보 약물로서 계속 진행하기에 바람직하지 않습니다.
Doyle 등[16]은 생물물리학적 방법을 활용하여 후보 물질 선정을 포함한 발견 과정 중에 이중특이적 Adnectin 후보 물질을 분석한 사례 연구 결과를 발표했습니다. 활용된 생물물리학 분석법은 SEC, AUC, SEC-MALS, X선 결정법, SPR, DSF, DSC였습니다. DSC로 수행된 두 가지 Adnectin 후보 물질의 비교에서 후보 물질 B는 후보 물질 A에 비해 TM과 Tonset이 더 높은 것으로 나타났습니다. 후보 물질 B는 또한 DSC에서 접힘 비가역성의 증거를 보여주었습니다. 즉, DSC에서 단백질 샘플을 냉각하고 재가열했을 때 두 번째 가열 주기에서 같은 프로필을 보여주었습니다. 이러한 비가역성은 발현 수준이 높고 응집물을 형성하는 경향이 낮다는 것을 의미하기도 합니다.
시판 중이거나 임상 연구가 진행 중인 바이오 약제 중 크기가 가장 큰 단백질 종은 단일클론 항체입니다. 단일클론 항체는 일반적으로 DSC에서 복잡한 여러 영역 서모그램을 나타냅니다(예시로 그림 2 참조). 가장 크고 가장 두드러진 영역 피크는 항체의 Fab(항원 결합 분절)입니다. 대개는 C
H2 및/또는 CH3 영역도 관찰됩니다. 서로 다른 영역의 상대적 위치와 TM은 아래 예시에서 보는 것처럼 특정 단일클론 항체에 따라 결정되며, 서브클래스 및 엔지니어링에 따라 달라집니다.
2007년에 Garber와 Demarest는 DSC를 사용하여 17개의 전장 치료 항체를 분석한 논문을 발표했습니다[17,18]. MicroCal VP-Capillary DSC를 사용해 분석했을 때 이러한 항체의 Fab는 중간점(TM)이 57°C ~ 82°C로 변동하는 열적 풀림 전이를 보여주었습니다. 저자는 IgG1이 가장 안정적인 인간 서브클래스였고, IgG2와 IgG4가 그 뒤를 이었으며, 활용된 예시에서는 유사한 서브클래스의 항체간에 안정성의 변화가 다양한 영역에서 도출되었다고 설명하였습니다. 각 V 유전자의 고유한 특징은 Fab 안정성 범위를 크게 넓혔습니다.
몇몇 항체의 Fab는 매우 안정적인 반면 다른 항체는 상대적으로 불안정할 수 있습니다. 참고 문헌 17에 포함된 여러 구성물에서 관찰된 아주 낮은 Fab 안정성(TM으로 측정)은 높은 Fab TM을 가진 항체와 비교했을 때 낮거나 매우 낮은 항체 발현 및 응집 증가 문제와 관련되어 있었습니다. 그 결과 낮은 TM을 가진 단백질은 정제하기가 더욱 어렵고, 이로 인해 공정 개발 시 산출량 감소할 뿐만 아니라 저장 중에 응집이 발생할 가능성이 높아집니다. 이 연구의 데이터[17]는 DSC 안정성 데이터가 바이오 약물의 후보 물질 선정에 있어 유용한 도구라는 증거를 제시하였습니다.
Ionescu 등[19]은 MicroCal VP-Capillary DSC를 사용하여 중성 pH에서 3개의 인체적합화 IgG1 단일클론 항체와 그 Fab 및 Fc 분절(효소 소화 후)에 대한 DSC 프로필을 만들었습니다. 일부 예외를 제외하고 서모그램은 더 큰 실험 엔탈피를 가진 전이가 Fab 분절의 기여를 받는다는 것을 보여주었습니다(참고 문헌 17의 결과와 유사). 또한 동일한 인간 생식 세포에서 기원한 Fab 분절의 경우에도 겉보기 TM이 크게 변동하였습니다. Ionescu 등은 주요 매개 변수인 풀림 엔탈피를 사용하여 온전한 IgG1 항체의 용융 프로필에서 풀림 작용을 알아볼 것을 제안했습니다. 일부 DSC 서모그램은 두 가지 전이 형태를 보여주었습니다. 첫 번째 전이는 Fab 분절과 CH2 영역의 풀림을 나타냈고 두 번째 전이는 CH3 영역 풀림을 나타냈습니다. 다른 항체에서는 첫 번째 DSC 전이가 CH2 영역 풀림을 나타냈고 두 번째 전이는 Fab 분절 및 CH3 영역의 풀림을 나타냈습니다. 다른 사례에서는 DSC 프로필이 3가지 전이로 나타났습니다. 즉, CH2 및 CH3 영역에서 용융이 발생한 데 비해 다른 온도에서 Fab 풀림이 발생했습니다. Fab 분절의 낮은 안정성 또는 비균질성은 장기 보관 또는 일관된 생산에 문제가 있음을 입증하는 것일 수 있습니다. 저자는 치료용 단일클론 항체 개발의 초기 단계에서 후보 물질 선정에 있어 DSC 프로필의 특징을 완전히 이해하는 것이 중요하다고 제안하였습니다.
위에서 설명한 2건의 논문과 같은 기간에 발행된 다른 논문에 설명된 작업은 후속적인 사례 연구는 물론 바이오 약제의 후보 물질 선정의 일환으로서 DSC의 활용과 기타 안정성 분석 연구를 위한 토대를 제공하였습니다.
후보 약물의 열적 안정성을 더욱 명확히 하기 위해 종종 한 가지 이상의 pH 조건에서 단백질을 분석하여 차이가 발생하는지 여부를 파악합니다. 이러한 여러 pH 조건은 약물의 제조 시 사용되는 포뮬레이션 및/또는 공정용 완충액에서 발생하는 조건을 대표할 수 있습니다.
Jiang 등[20]은 선정된 HOS에 대한 특성 분석을 통해 2개의 단일 클론 항체 약물 후보에 대한 개발 가능성(제조 가능성 및 전반적인 제품 품질을 유지하는 능력)을 평가한 사례 연구를 발표했습니다. X 및 Y 항체는 동일한 대상을 표적으로 한 IgG2 mAb로, 유사한 생물학적 활성도를 나타냈습니다. 연구는 DSC, near UV CD, FTIR, DLS, 형광측정법, 분광법, SEC 등의 생물물리학 기법을 조합하여 다음과 같은 내용을 분석했습니다.
항체 정체 및 바이러스 불활화 시 사용되는 완충액을 재현하는 데는 산성 조건(pH 3)을 선택하였고 pH 5의 완충액으로 보관 조건을 시뮬레이션했으며 pH 7의 완충액을 정제 전반에 사용했습니다.
pH 7 완충액(PBS)에 든 2개의 mAb 후보 물질에 대한 MicroCal VP-Capillary DSC 스캔은 두 가지 전이 형태를 보였습니다. 즉, CH2/Fab 영역은 첫 번째 전이를 나타낸 반면 CH3 영역은 두 번째 전이에 의한 풀림을 나타냈습니다[20]. mAb Y는 DSC의 TM이 더 높고 풀림 시점 온도(Tonset)가 더 높은 것으로 비추어 pH 7에서 열적 안정성이 조금 더 높았습니다. pH 3의 완충액(C3N)에서는 각 후보 물질에서 하나의 DSC 열 전이만 있었습니다. 이는 낮은 pH로 인해 시작 온도에서 이미 샘플이 부분적으로 풀렸다는 것을 의미합니다. pH 3에서 두 후보 물질의 풀림 시 열 전이 온도 및 엔탈피는 예측한 대로 PBS에서보다 현저히 낮았습니다. 그러나 중성 pH에서는 mAb Y가 열적 안정성이 높았지만 C3N에서는 mAb X(TM = 63.2°C)가 mAb Y(TM = 48.2°C)보다 열적 안정성이 뛰어났습니다. 이러한 결과는 이례적이었지만 pH 3에서 mAb X가 더 많은 3차 구조를 유지했던 near UV CD의 데이터와 일치했습니다. pH 3 처리에 의해 유도된 두 후보 물질의 열적 안정성 변화는 PBS로 투석한 후 완전한 가역성을 나타냈습니다.
전체적으로 DSC 결과는 두 단백질이 모두 중성 pH에서 아주 안정적이지만 PBS에서는 mAb Y의 열적 안정성이 mAb X보다 높고 C3N에서는 mAb X보다는 낮다는 것을 지적했습니다[20]. CD 및 DSC 데이터는 mAb Y가 pH 3에서 mAb X보다 더 많은 구조적 변화를 겪는다는 것을 보여주었습니다. pH 3에서 유도된 열적 안정성 변화는, mAb Y의 경우 3차 구조의 변화가 아주 부분적으로 비가역적인 것으로 나타났지만 두 mAb에서 모두 완전히 가역적이었습니다. mAb X에 비해 mAb Y는 중성 pH에서 열적 안정성이 더 우수했고 pH 5의 포뮬레이션 완충액에서 37°C로 보관했을 때 보관 안정성이 개선되었습니다. 종합해볼 때 공정 안정성(pH 변화에 대한 내성)과 보관 안정성(온도 상승의 영향)에 대한 촉진 요인은 서로 다르다는 결과가 제시되었습니다.
접힌 mAb Y는 pH 7의 PBS에서 열적 안정성이 높았고 37°C에서 보관할 때 pH 5에서 안정성이 더 높았기 때문에 개발을 진행하기에 적합한 물질로 mAb Y를 권고했습니다[20]. 또한 두 3차 구조 파괴의 비가역성과, 낮은 pH에서 배양 후 관찰된 PBS에서의 자가 결합을 이유로 mAb Y를 계속 진행하는 권고와 함께 pH 3에 대한 mAb Y의 노출을 최소화하는 정제 공정을 개발할 것을 권장하는 권고가 함께 제공되었습니다. 이 사례 연구는 후보 물질을 선정하고 공정을 개발하는 과정의 일환으로서 안정성 데이터가 어떻게 공정에 의해 발생하는 비가역적 응집물의 양과 구조적 변형을 최소화함으로써 궁극적으로 공정 산출량을 증가시키는 데 도움이 되는지를 보여주었습니다[20].
DSC의 열적 안정성 분석을 활용하여 개발 가능성을 평가하고 예측한 몇가지 추가 사례 연구가 Satish 등의 논문에 요약되어 있습니다.[21]
Tavakoli-Kenshe 등[22]은 안정성 연구 외에 개발 가능성을 예측하는 데 활용할 수 있는 다른 예측 인자가 있는지 알아보고자 했습니다. 이들은 IgG1 및 IgG4의 다섯 가지 변이형에 주목해 알려진 고체-액체 계면에서 정의된 전단 조건을 만들어주는 회전식 디스크 전단 장치를 사용해 이러한 환경에서의 안정성을 측정했습니다. 이 연구는 기법의 상호 보완성을 연구하기 위해 전단 장치 출력에 기초하여 항체의 안정성 순위를 분석하고, MicroCal VP-Capillary DSC에서 얻은 가속 열적 안정성 데이터와 CH2 영역의 용융 온도(TM1)를 사용해 결과를 비교하였습니다. 그 결과 기법들은 분자 내 상호 작용에 기초한 열적 방법과는 독립적이었으며 국부적 풀림에 기초한 전단 장치 안정성은 응집을 유도하는 덜 안정적인 영역을 드러냈습니다. 분자 모델링은 항체 구조에 대한 변이의 효과를 보여주는 한편 부유 단백질의 안정성을 측정하는 데 있어 Fc 형태 및 Fab-Fc 도킹의 역할이 있을 수 있다는 점을 시사하고 있습니다. 연구 데이터는 DSC와 같은 기존의 열적 방법을 보완하는 잠재적인 독립적 안정성 지표로서 전단 테스트를 도입함으로써 단백질 후보 물질 선정과 정제 공정의 안정성 개선을 가능하게 하였습니다.
바이오 약제 발견에 흔히 사용되는 ‘적중(hit)’ 분자 또는 ‘상위’ 단백질 약물 분자는 생물물리학적 특성을 개선하고 단백질의 개발 가능성을 높이기 위해 수정이나 엔지니어링을 거칩니다. 엔지니어링이 완료된 후에는 후보 물질을 선정하기 전에 엔지니어링된 다양한 단백질의 안정성을 평가하여 엔지니어링으로 해로운 효과가 발생하지 않는지 확인하는 것이 중요합니다. 이에 대한 예시는 상위 단백질과 2개의 엔지니어링된 항체에 대해 MicroCal VP-Capillary DSC을 선별 도구로 사용하여 엔지니어링된 구성물의 열적 안정성과 개발 가능성을 예측한 Malvern 응용 노트[23]에 제시되어 있습니다. SEC를 통한 가속 보관 후 응집 형성 연구도 포함되어 있습니다. TM이 가장 크게 감소한 가공 항체는 가속 안정성 선별 후 가장 많은 응집물이 형성된 항체 구성물과 상관 관계가 있었으며 이러한 사실은 후보 물질 선정에 있어 중요한 지침이 됩니다.
Demarest 등은 불안정한 Fab를 엔지니어링한 다음 입증을 위해 MicroCal VP-Capillary DSC를 이용하여 개선된 단백질 안정성을 살펴보았습니다[18, 24]. 항체 및 항체 분절 안정화 전략을 개발하기 위해 인간 소스로부터 격리된 파상풍 변독소(αTT)를 인식하는 부실한 거동의 Fab를 선택한 다음 돌연변이 생성 캠페인을 수행하여 Fab에 다시 안정성을 높이는 가공을 하였습니다. 저자는 무작위 추출을 위해 45개의 잔여물 위치를 선택하고 4500개에 가까운 개별 군집을 골라 발현 배지에서 배양했습니다. 발현된 Fab가 포함된 상청액에는 3가지 고온(70°C, 72°C, 74°C)으로 열을 가했습니다. 향상된 열 안정성을 나타낸 변이형은 해당 특성을 확인하기 위해 열 내성 검사를 다시 실시했습니다(참고 문헌 24에서 안정화 돌연변이에 대한 전체 목록 참조). 라이브러리에서 약 1%의 변이는 향상된 열 안정성을 나타냈습니다. 14개의 "유효 물질"은 VH 영역에, 나머지 4개는 VL 영역에 위치했습니다. 이 결과를 통해 네이티브 Fab의 안정성은 VH의 한계 안정성으로 제한됨을 알 수 있습니다. 놀랍게도, 구성 요소 약 2000개 단위의 불변 영역 라이브러리 내의 어떤 돌연변이도 Fab를 전체적으로 안정화하지 않는 것으로 나타났습니다. 저자는 불변 영역 내에서 안정화 돌연변이가 일어났으나 VH 영역의 제한된 안정성으로 인해 Fab가 풀리고 해당 반응의 관찰이 제한된 시점의 온도가 조절된 것으로 추측했습니다.
4개의 안정화 돌연변이는 αTT VL 영역 내에서 발견되었습니다[24]. Ala(VK1에 대한 공통 잔여물) 또는 His에 대한 VK4 공통 잔여물 W50의 돌연변이는 상당히 안정화되었습니다. 히스티딘은 인간 카파 가변 영역의 포지션 50에서 드물게 발견되지만 인간 람다 가변 영역에서도 발견됩니다. 이 잔여물은 VH/VL 영역 경계에 가깝습니다. 저자는 특히 VH 영역이 αTT Fab의 안정성을 제한하는 것으로 보이므로 Fab 안정성에 대한 기여도는 VH 영역의 버팀 효과와 연관될 수 있다고 가정했습니다. 그러나 고립된 VL 영역으로 수행한 연구는 다른 결과를 보여 줍니다.
돌연변이 초기 검사에서 확인된 3개 ~ 11개의 안정화 돌연변이를 포함하여 12개 구성물이 생성되었습니다[24]. 각 돌연변이가 Fab 안정화에 제공한 겉보기 기여도를 측정하기 위해 다양한 조합을 유도했습니다. 평행 변환/발현 실험에서 αTT Fab에 대한 여러 안정화 돌연변이를 도입한 경우 Fab 발현이 증가했습니다. 이는 더욱 안정적인 구성물로 인해 세포의 발현이 증가했다는 것을 의미합니다. 이 최고 구성물은 야생형에 대해 발현량이 3배 이상 지속적으로 증가했습니다. 각 Fab의 안정성은 DSC 및 원이색법(CD)으로 평가했습니다. 측정된 TM 값을 사용하여 겉보기 Fab 안정성에 대한 순위를 매겼습니다.
한 가지 고려해야 할 주요 사항은 이러한 돌연변이가 αTT Fab의 기능적 항원 결합에 미칠 수 있는 잠재적인 영향입니다. 열 안정화 돌연변이는 CH1의 C 말단에서 CL 영역과 히스티딘 태그를 검출하는 정량적 ELISA를 사용하여 원래 검사에서 유도했습니다. 저자는 열 안정화 돌연변이가 야생형에 비해 기능 ELISA에서 αTT Fab의 겉보기 친화도를 향상시킨 것으로 보았습니다[24]. 각 Fab 변종의 기능적 용량은 DSC의 TM으로 설명한 것과 같이 안정성과 직접적으로 상관이 있는 것으로 나타났습니다. 기능적 활성도 및 단백질 발현이 DSC의 TM과 상관 관계를 가질 수 있다는 것은 가장 안정적인 구성물을 선택함으로써 개발 가능성을 높일 수 있다는 것입니다.
Seeliger 등[25]은 전산 설계 전략을 이용하여 체외(in vitro)에서 응집하는 경향을 보이는 항체를 체계적으로 변형했습니다. 야생형(WT) mAb1을 엔지니어링한 일련의 밀접한 관련 항체들은 생물물리학 방법(MicroCal VP-Capillary DSC 포함)과 장기 안정성 실험에서 평가된 대로 개선된 안정성을 보여주었습니다. Demarest 등이 αTT Fab를 사용한 위의 예시에서 언급한 것처럼[24] 돌연변이 단백질 발현 수준도 야생형 후보 물질보다 개선되었습니다. 더불어 이 연구에 사용된 실험 및 전산 데이터는 전산적 방법을 사용하여 안정성 개선을 위한 항체 최적화를 이끌어 낼 수 있는 방법을 보여주고 있습니다.
원래 야생형 단백질의 DSC는 Fab 영역으로 식별된 서모그램의 첫 번째 전이에 대해 68°C의 TM을 보여주었습니다. 중연쇄 또는 경연쇄 돌연변이에 대한 DSC 서모그램에서는 DSC의 첫 번째 열 전이(Fab)에 대한 TM가 68.9°C - 72.8°C로 높아졌습니다. 엔지니어링된 중연쇄 및 경연쇄를 가진 돌연변이에서는 첫 번째 흡열 반응은 70.5°C에서 관찰되었고 83.5°C에서 더 큰 피크(Fab)가 있었습니다. 항체 Fab 풀림에 대한 TM은 중연쇄 및 경연쇄에서 예측된 '유발 인자'를 제거한 후 약 16K 증가했습니다. 트립토판 형광성의 변화를 통해 풀림을 모니터링했을 때에도 같은 경향이 관찰되었습니다[25].
컴퓨터 시뮬레이션은 도입된 대부분의 돌연변이가 열적 안정성이 높일 것으로 예측했습니다. 이러한 결과는 DSC 및 RALS(직각 광 산란) 측청에서 얻은 결과와 비슷했습니다. 두 실험은 모두 돌연변이 수를 늘림에 따라 안정성이 연속적으로 증가함을 보여주었습니다. 두 실험에서 저자는 경연쇄 엔지니어링이 안정성에 괄목할 만한 효과가 있으며 이것이 각 돌연변이에 대해 계산된 열 안정성 변화와 일치한다는 사실을 발견했습니다[25].
엔지니어링된 모든 mAb1 변이형은 50mg/L 이상의 적정 농도로 발현된 반면 야생형의 경우 mAb1 적정 농도가 1mg/L 미만이었습니다. 단 하나의 가공 사슬만을 가진 변이형의 발현 수준이 크게 증가한 것은 DSC 결과로부터 예측할 수 없었으며, 이러한 점은 이러한 변이형의 안정성 증가가 적다는 것을 보여주었습니다. 그러나 계산은 도입된 돌연변이로 개별 면역글로불린 영역의 안정성이 개선됨을 시사하고 있습니다. 가열이 수반된 실험에서는 각 개별 사슬의 안정성이 제한 요인인 것으로 보였으며, 이는 관찰된 효과가 열역학적 균형 효과가 아닌 운동역학적 효과임을 나타내는 것입니다. 한 영역이 풀리자마자 집합체 형성의 안정화 효과가 사라지고 그에 따라 두 번째 사슬도 풀리기 시작합니다. 체외(in vivo) 단백질 생성 및 접힘의 경우 덜 안정적인 사슬에 대한 핵점(nucleation point)으로 작용하는 안정적으로 접힌 영역의 존재가 성공적으로 접힌 항체의 양을 크게 증가시키기에 충분할 수 있습니다[25].
바이오 약제를 개발하는 회사의 관점에서 단계적인 단백질 안정성 증가(DSC 및 기타 생물물리학적 분석법의 결과)가 곧 단계적인 장기 안정성 개선과 보관 수명 개선을 의미할 수 있을까요? 저자는 엔지니어링된 변이형을 사용하여 40 °C에서 가속 안정성 연구를 수행하였고 SEC의 단량체 함량에 비추어 장기 안정성의 상당한 개선이 있음을 관찰했습니다. 또한 완전히 엔지니어링된 변이형은 4개월의 전체 테스트 기간 중에 가장 안정적이었습니다[23]. 가변 영역의 열적 안정성은 장기 안정성에 있어 확실히 중요한 요인입니다. 그러나 저자의 데이터와 기타 발간된 데이터를 고려할 때 열적 안정성과 보관 수명이 모든 사례에서 쉽게 상관 관계를 가진다고 할 수 없으며, 포뮬레이션 단계에서 안정성을 개선하기 위해 조정이 필요할 수 있다는 점도 분명합니다[25,26,27,28].
최근의 간행물들은 합리적인 엔지니어링과 DSC 및 기타 생물물리학 도구를 사용한 단백질 안정성 분석과 함께 다음과 같은 내용에 대해 설명하고 있습니다.
국립 표준 기술 연구소(NISTmAb)의 단일 클론 항체 기준 물질[35]은 mAb 후보 약물에 일반적으로 사용되는 HOS 생물물리학 도구를 통해 개발 가능성을 평가 받았습니다. NISTmAb는 치료용 분자로 개발되지 않았으며 NISTmAb에 대한 평가는 대표적인 종특이적 IgG1 mAb로서 수행되었습니다[36]. NISTmAb는 SEC-MALS, DLS, DSC 방법을 사용하여 다양한 완충액 조건하에서 안정성과 무결성을 평가 받았습니다. PBS 완충액에 든 NISTmAb 샘플의 열적 안정성은 MicroCal VP-Capillary DSC로 측정되었습니다. NIST 샘플에서 3개의 열 전이는 71.2°C에서 CH2 영역이, 84.1°C에서 CH3 영역이, 88.9°C에서 Fab 영역이 나타났습니다.
참고 문헌 17의 IgG1 분자에 대한 DSC 프로필과 비교하여 NIST Fab는 더욱 안정적(88.9°C)이었으므로 해당 분자가 유리한 HOS 프로필을 가진 것으로 결론을 내렸습니다[36]. 전체 생물물리학 분석 데이터 패키지에 근거할 때 NISTmAb는 유리한 개발 가능성 프로필을 보였고 스트레스 조건이 가해진 이후 분자에서 관찰된 변화는 개발 공정의 후반 단계에서 적절한 포뮬레이션과 제조를 통해 완화될 수 없는 위험을 나타내지 않았습니다.
본 백서에 제시된 결과는 바이오 약제 후보 물질 선정 중에 생물물리학적 안정성 분석으로서 DSC를 함께 활용하는 것의 중요성과 효과성을 명확하게 입증하고 있습니다. 바이오 제약 회사는 DSC 결과를 다른 안정성 분석과 함께 사용하여 가장 안정적이고 개발 가능한 후보 약물에 대해 정보에 기초한 의사결정을 내릴 수 있으며, 이는 곧 그러한 약물이 생산과 정제에 있어 최적의 선택안이며 최종 포뮬레이션 및 약품에서 장기 안정성 문제와 응집 문제가 나타날 가능성이 낮아진다는 것을 의미합니다. 달리 말하면 약물 생산의 경제성이 높아지고 최종 약물 포뮬레이션이 활성 상태에서 정확히 접힌 형태로 안정적인 상태를 유지할 가능성이 높아진다는 뜻입니다.
Analytical Techniques for Biopharmaceutical Development(바이오 약제 개발을 위한 분석 기법), R. Rodriguez-Diaz, T. Wehr, S. Tuck (eds.), Taylor & Francis, New York USA (2005).
Biophysical Characterization of Proteins in Developing Biopharmaceuticals(바이오 제약 개발 시 단백질의 생물물리학적 특성 분석), D.J. Houde, S.A. Berkowitz (eds.), Elsevier, Amsterdam, Netherlands (2015).
Biophysical Methods for Biotherapeutics: Discovery and Development Applications(바이오 치료제를 위한 생물물리학 방법: 발견 및 개발 응용 분야), T.K. Das (ed.) John Wiley & Sons, Hoboken NJ USA (2014).
Biophysics for Therapeutic Protein Development(치료용 단백질 개발을 위한 생물물리학), L.O. Nahri (ed.), Springer New York, USA (2013).
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 1. Monoclonal Antibody Therapeutics: Structure, Function, and Regulatory Space(치료용 단일클론 항체 특성 분석을 위한 첨단 및 신생 기술 1권, 단일클론 항체 치료: 구조, 기능 및 규제 공간), J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Vol 1176 (2014). doi: 10.1021/bk-2014-1176.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 2. Biopharmaceutical Characterization: The NISTmAb Case Study(치료용 단일클론 항체 특성 분석을 위한 첨단 및 신생 기술 2권, 바이오 제약 특성 분석: NIST mAb 사례 연구), J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Vol 1201 (2015). doi: 10.1021/bk-2015-1201.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 3. Defining the Next Generation of Analytical and Biophysical Techniques(치료용 단일클론 항체 특성 분석을 위한 첨단 및 신생 기술 3권, 차세대 분석 및 생물물리학 기법의 정의), J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Vol 1202 (2015) DOI: 10.1021/bk-2015-1202.