Práticas recomendadas para Calorimetria de Titulação Isotérmica para estudar interações de ligação – Parte 1
Aqui estão várias práticas recomendadas para realizar experimentos tradicionais de ligação com os sistemas MicroCal PEAQ-ITC, VP-ITC e ITC200.
Requisitos de amostra:
-
- Por convenção, a “Macromolécula” é a biomolécula na célula dos calorímetros de titulação isotérmica (ITC), e o “ligante” é a biomolécula na seringa do ITC. Esses podem ser quaisquer moléculas (proteína, ácido nucleico, inibidor de pequenas moléculas, metal etc.) que interagem entre si. “Titulações reversas” também podem ser feitas, com o “ligante” na seringa.
- O “ligante” possui um local de ligação, para fins de análise de dados ao modelo de ligação de um conjunto de sítios, e outros modelos de análise de dados de ITC comumente usados. A “macromolécula” pode ter qualquer número de locais de ligação.
- Todas as amostras devem ser o mais puras possível para ITC. Evite ou elimine impurezas químicas e conformacionais, pois estas podem afetar a determinação precisa da concentração e possivelmente estar envolvidas ou interferir na interação de ligação.
- Para dados de ITC de alta qualidade, ambas as biomoléculas devem estar no buffer desejado, para evitar alterações térmicas devido a incompatibilidade de buffer.

- Buffer para ITC:
- Utilize um buffer que mantenha a solubilidade e estabilidade das biomoléculas, e inclua quaisquer sais, cofatores e aditivos necessários para a ligação.
- Como ponto de partida, você pode usar o mesmo buffer utilizado em outros estudos de ligação.
- ITC é compatível com buffers aquosos entre pH2-pH12. Certifique-se de que a concentração do buffer é suficiente para manter o pH na presença das biomoléculas.
- Se o buffer contiver glicerol (ou outro componente viscoso), mantenha a concentração de glicerol abaixo de 20% (v/v), para evitar bolhas na célula de ITC e na seringa de injeção.
- Se o buffer contiver um surfactante ou detergente, mantenha a concentração de surfactante abaixo de sua concentração micelar crítica (CMC), a menos que você esteja estudando micelas com ITC.
- Se for necessário um agente redutor, recomendamos o uso de TCEP ou 2-mercaptoetanol. Ditiotreitol não é recomendado.
- Se um ligante precisar de DMSO para solubilidade, certifique-se de ter a mesma concentração final de DMSO em ambos os parceiros de ligação. O limite superior recomendado é de 10% de DMSO para estudos de ligação por ITC.
- Se você precisar usar outro solvente orgânico, verifique a literatura técnica do instrumento ou consulte sua equipe de suporte regional da Malvern Panalytical, para recomendações e compatibilidade química do seu sistema ITC.
Volumes de amostra:
- Veja a Tabela 1. Esses são os volumes recomendados necessários para encher a célula de ITC e a seringa usando protocolos recomendados, sem a adição de bolhas.

Concentrações de amostra:
- A concentração inicial da macromolécula na célula de ITC é tipicamente determinada pelo “parâmetro C” ou “fator de sigmoidicidade”, determinado por:
C= N[M]T/KD - [M]T é a concentração de macromolécula na célula de ITC, e N é a estequiometria. Para obter uma isotérmica de ligação de ITC razoável, o intervalo ideal é 5 < C < 500. Em muitos casos, você pode obter alguns dados úteis de uma curva de ligação de ITC quando C está entre 1 e 1000.
- Para ligação 1:1, comece com uma concentração de ligante 10 vezes maior na seringa de ITC em comparação com a concentração de macromolécula na célula de ITC.
- Se você tiver um KD estimado e houver ligação 1:1, use o guia na Tabela 2. Supondo que haja uma alteração térmica razoável e entalpia de ligação, essas faixas de concentração devem fornecer uma curva de ligação.
- Se KD for desconhecido, tente 20 μM de amostra na célula de ITC e 200 μM de amostra na seringa de ITC.
- Concentração mínima na célula de ITC: 5-10 μM
- Concentração mínima na seringa de ITC: 50 μM
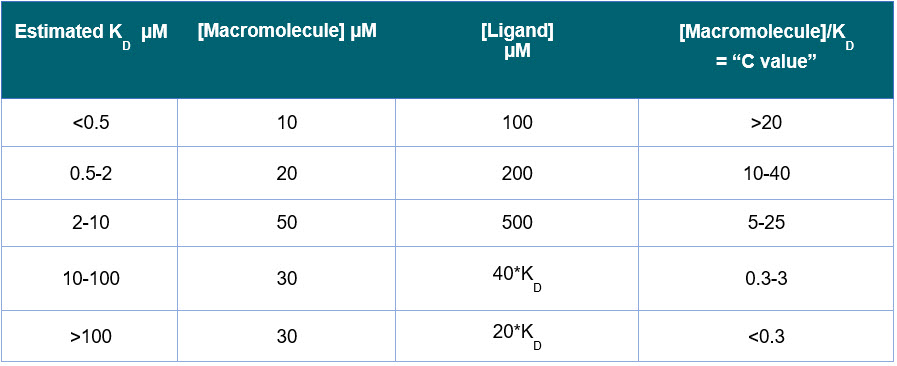 Tabela 2: Concentrações recomendadas para experimentos de ITC se você tiver um KD estimado e ligação 1:1[/caption>
Tabela 2: Concentrações recomendadas para experimentos de ITC se você tiver um KD estimado e ligação 1:1[/caption>
Conteúdo relevante:
- Calorimetria de Titulação Isotérmica: Teoria e Prática
- Dicas práticas para experimentos MicroCal PEAQ-ITC
- Abordando a complexidade das interações de ligação com ITC – obtenha o máximo dos seus dados de ITC
- Biomoléculas: qualidade da amostra e dos dados na análise de interação – Duas faces da mesma moeda
- Não descarte seus dados de ITC com valor N “ruim”
- Padrão ouro para afinidade de ligação
Postagens anteriores:
- Melhores Práticas para ITC para estudar interações de ligação – Parte 2
- Melhores Práticas para ITC para estudar interações de ligação – Parte 3
- Melhores Práticas para ITC para estudar interações de ligação – Parte 4
- Calorimetria de Titulação Isotérmica – Uma ferramenta quente para caracterização de interações biomoleculares
- Clube do Jornal de ITC
- O que há de novo em ITC? Edição de junho de 2018
Este artigo pode ter sido traduzido automaticamente
{{ product.product_name }}
{{ product.product_strapline }}
{{ product.product_lede }}

