Was ist Zeta-Potential? -1 : Einführung in die Zeta-Potential-Messmethoden
Einführung
Das Zetapotential ist eine physikalische Eigenschaft, die alle Partikel in einer Suspension beschreibt. Es kann auch das Verhalten von Suspensionen und Emulsionen klar zeigen. Ein Verständnis des Zetapotentials kann die Zeit zur Erstellung einer Versuchsformulierung verkürzen und ermöglicht Vorhersagen über die Langzeitstabilität.
Kolloid-Wissenschaft
Die drei grundlegenden Zustände der Materie sind fest, flüssig und gasförmig. Wenn einer dieser Zustände fein in einem anderen verteilt ist, spricht man von einem kolloidalen System. Diese Materialien zeigen eine besondere Eigenschaft von großem praktischen Nutzen.
Kolloidale Systeme umfassen Beispiele wie Aerosole, Emulsionen, kolloidale Suspensionen und Assoziationskolloide. Unter bestimmten Bedingungen können Partikel in der Dispersion aggregieren und größere Aggregate bilden, die der Schwerkraft unterworfen sind.
Die anfänglich entstandenen Aggregate werden als Flocken bezeichnet, und der Prozess ihrer Bildung wird Flockung genannt. Flocken können zu Sedimentierung oder Phasentrennung führen oder auch nicht. Wenn diese Aggregate dichter werden, spricht man von Verfestigung.
Partikelverbindungen führen zu Sedimentation, wenn sie dichter als das Medium sind, und zu Aufrahmung, wenn sie weniger dicht sind. Diese Prozesse des Flockens und Verfestigens können oft wechselseitig auftreten.
In der Regel ist die Verfestigungsreaktion im Gegensatz zur reversiblen Natur der Flockung irreversibel und führt zu Deflockulation.
Abbildung 1 zeigt diesen Prozess.

Kolloid-Stabilität und DVLO-Theorie
1940 entwickelten Wissenschaftler Derjaguin, Verwey, Landau und Overbeek eine Theorie zur Stabilität in kolloidalen Systemen. Die DVLO-Theorie schlägt vor, dass die Partikelstabilität in Lösung von der Gesamtenergie der Partikel abhängt, die durch verschiedene Beiträge beeinflusst wird.
![]() ist definiert durch den Einfluss bestimmter Komponenten.
ist definiert durch den Einfluss bestimmter Komponenten.
![]()
![]() ist die potenzielle Energie des Lösungsmittels und die am wenigsten beitragende Terme bei der Trennung der letzten Nano-Partikel der potentiellen Gesamtenergie. Die einflussreicheren Faktoren sind das Gleichgewicht zwischen
ist die potenzielle Energie des Lösungsmittels und die am wenigsten beitragende Terme bei der Trennung der letzten Nano-Partikel der potentiellen Gesamtenergie. Die einflussreicheren Faktoren sind das Gleichgewicht zwischen ![]() und
und ![]() , wobei sie die Verteilung von anziehenden und abstoßenden Kräften darstellen.
, wobei sie die Verteilung von anziehenden und abstoßenden Kräften darstellen.
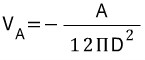
representiert und A ist die Hamaker-Konstante und D die Partikeltrennung.
representiert
die abstoßende Potenzial ![]() hat eine komplexere Funktion.
hat eine komplexere Funktion.
![]()
a ist der Partikelradius, π ist die Löslichkeit des Lösungsmittels, κ die Ionenzusammensetzung und ζ ein Funktionsmerkmal des Zetapotentials.

Laut DVLO-Theorie wird die Stabilität von kolloidalen Systemen durch den additiven Einfluss der van der Waals-Anziehungskräfte und der abstoßenden Kräfte der elektrischen Doppelschicht während der Brownschen Bewegung der Partikel bestimmt. Diese Theorie zeigt eine Energiebarriere, die die Annäherung von Partikeln verhindert, indem abstoßende Kräfte wirksam werden.
Doch Partikel, die diese Energiebarriere nicht überwinden können, aggregieren aufgrund der unwiderstehlichen Anziehungskräfte irreversibel. Wenn jedoch die Partikel eine ausreichend hohe Abstoßungskraft aufweisen, verhindern sie jede Flockung, und das kolloidale System bleibt stabil.
Fehlt jedoch ein Abstoßungsmechanismus, führen Flockung oder Verfestigung letztlich zur Sedimentation.

Verringert sich das Zetapotential (z.B. bei hoher Salzkonzentration), können schwächere, potenziell reversible Bindungen zwischen Partikeln entstehen, die ein „sekundäres Minimum“ generieren könnten (Abbildung 2 (b)).
Diese schwachen Flocken sind stabil genug, um nicht durch die Brownsche Bewegung zerstört zu werden, könnten jedoch durch äußere Kräfte wie forciertes Rühren wieder dispergiert werden.
Daher müssen in einem stabilen kolloidalen System abstoßende Kräfte dominieren. Wie erreicht man Stabilität in einem kolloidalen System?
Es gibt zwei grundlegende Mechanismen, die die Stabilität der Dispersion beeinflussen.
Sterische Abstoßung – Dies beinhaltet Polymere, die die Annäherung von Partikeln am Partikeloberfläche verhindern. Bei ausreichender Absorption können sterische Schichten eine ausreichend dicke Trennung zwischen Partikeln aufrechterhalten, so dass die van der Waals-Kräfte zu schwach sind, um Partikel zusammenzubringen.

Elektrostatische oder Ladungsstabilität – Dies bezieht sich auf die Partikelinteraktionseffekte basierend auf der Ladungsverteilung im System. Jedes der Mechanismen bietet Vorteile je nach System. Sterische Stabilität kann einfach mit geeigneten Polymeren erreicht werden. Polymeren können jedoch teuer sein und sind möglicherweise nicht geeignet, z.B. wenn keramische Schichten während des Gießens und Sinterns verbrennen, was kontraproduktiv ist und Schrumpfung verursacht.
Elektrische oder Ladungsstabilisierungserfolg kann erreicht werden, indem einfach die Ionenverteilung im System angepasst wird, was sich für koagulierte Systeme eignet. Dies ist ein reversibler Prozess und nicht teuer. Zetapotential hat sich als bewährter Indikator für das Maß an Wechselwirkungen zwischen kolloidalen Partikeln etabliert, und das Messen des Zetapotentials wird üblicherweise verwendet, um die Stabilität des kolloidalen Systems zu überprüfen.
Oberflächenladung
Die meisten kolloidalen Dispersionsmittel in wässrigen Medien tragen eine Ladung. Obwohl die Oberflächenladung von den inhärenten Eigenschaften der Partikel und ihrer Umgebung abhängt, werden wir uns auf die wichtigeren Mechnismen konzentrieren.
Ionisation von Oberflächengruppen
Der Abbau von Säuregruppen auf der Partikeloberfläche führt zu einer negativen Oberflächenladung, während der entgegengesetze Prozeß, das Brechen von Basegruppen, eine positive Basenladung erzeugt.
Dieser Artikel wurde möglicherweise automatisch übersetzt
{{ product.product_name }}
{{ product.product_strapline }}
{{ product.product_lede }}
