Die Stabilität eines therapeutischen Proteinkandidaten ist entscheidend für den Erfolg oder Misserfolg der Entwicklung. Die Stabilität eines Proteins hat Auswirkungen auf dessen Produktion, Herstellung, Formulierung, Langzeit-Lagerfähigkeit, Verabreichung an den Patienten und Wirksamkeit. Hochstabile Proteine neigen weniger zu Problemen bei der Herstellung, sind kostengünstiger in der Produktion und haben eine bessere Chance, während Formulierung und Lagerung funktionsfähig zu bleiben. Beim QbD-Ansatz (Quality by Design) für die biopharmazeutische Entwicklung ist die Stabilitätscharakterisierung Teil der Erstbewertung der Entwicklungsfähigkeit oder Wirkstofffähigkeit eines Kandidatenmoleküls. Sie muss während der Verfahrensentwicklung und Herstellung laufend wiederholt werden. Die Stabilitätsdaten fließen auch in die Charakterisierung der höheren Ordnungsstruktur (HOS) und das Fingerprinting ein. Diese Daten werden zur Unterstützung der Herstellung sowie für biopharmazeutische Vergleichsuntersuchungen und Biosimilaritätsstudien herangezogen. Bei den Zulassungsanträgen für neue biopharmazeutische Wirkstoffe und Biosimilars wird die HOS-Charakterisierung von Proteinen zunehmend zum Standard.
Aufgrund des komplexen Charakters von Proteinen spielen biophysikalische Charakterisierungswerkzeuge eine wichtige Rolle in der Analyse biopharmazeutischer Produkte. Zur Bewertung der Proteinstabilität stehen unterschiedliche biophysikalische Werkzeuge zur Verfügung. Hierzu gehören u. a die CD-Spektroskopie (CD), die dynamische und statische Lichtstreuung (DLS und SLS), die Größenausschlusschromatographie mit Mehrwinkel-Lichtstreudetektoren (SEC-MALS), die Fourier-Transformations-Infrarotspektrometrie (FTIR), die analytische Ultrazentrifugation (AUC), die Größenausschlusschromatographie (SEC), die Differential-Scanning-Fluorimetrie (DSF), die intrinsische Fluoreszenz (IF) und die dynamische Differenzkalorimetrie (DSC).
Wenngleich all diese Verfahren in der biopharmazeutischen Entwicklung eine wichtige Rolle spielen, ist die Charakterisierung der thermischen Stabilität mittels DSC von entscheidender Bedeutung. Ein Artikel aus dem Jahr 2015 über biophysikalische Methoden zur Charakterisierung der höheren Ordnungsstruktur monoklonaler Antikörper (Gokarn et al.) stellt fest: „Die DSC ist nach wie vor ein konkurrenzloses Verfahren zur Beurteilung der thermodynamischen Stabilität von Proteinen unter gegebenen Pufferbedingungen“.[1]
Das vorliegende Whitepaper konzentriert sich auf den Einsatz der DSC zur Charakterisierung der thermischen Stabilität von Protein-Biopharmazeutika (v. a. von Antikörpern) in der Präformulierungs- und Formulierungsentwicklung. Zielsetzung ist dabei die Auswahl der Lösungsbedingungen, unter denen das Protein bevorzugt in seiner nativen, gefalteten Konformation vorliegt, um ein stabiles, wirksames Arzneimittel zu erhalten.
Die DSC ist ein mikrokalorimetrisches Verfahren, mit dem die thermische und konformationelle Stabilität von Proteinen, Nukleinsäuren, Lipiden und anderen Biopolymeren charakterisiert werden kann.[2-7] Die DSC misst die Wärmekapazität als Funktion der Temperatur. Bei den für die Proteincharakterisierung eingesetzten DSC-Geräten, wie sie in diesem Whitepaper beschrieben werden, handelt es sich um Leistungsdifferenzkalorimeter. Sie verfügen über eine ortsfeste Probenzelle, die das Biopolymer in einer Pufferlösung enthält, und eine entsprechende Referenzzelle, die mit der gleichen Pufferlösung befüllt ist. Der für die Probenzelle gemessene Wärmekapazitätswert (Cp) wird mit dem der Referenzzelle verglichen. Während die Temperatur der Zellen erhöht wird, wird der Temperaturunterschied zwischen Referenz- und Probenzelle kontinuierlich gemessen und in Leistungswerte umgewandelt. Die DSC wird als Forced-Degradation-Assay bezeichnet, da das Protein einer steigenden Temperatur ausgesetzt wird und sich dabei zu entfalten beginnt. Dabei nimmt der Cp-Wert des Proteins entsprechend zu (Abbildung 1).
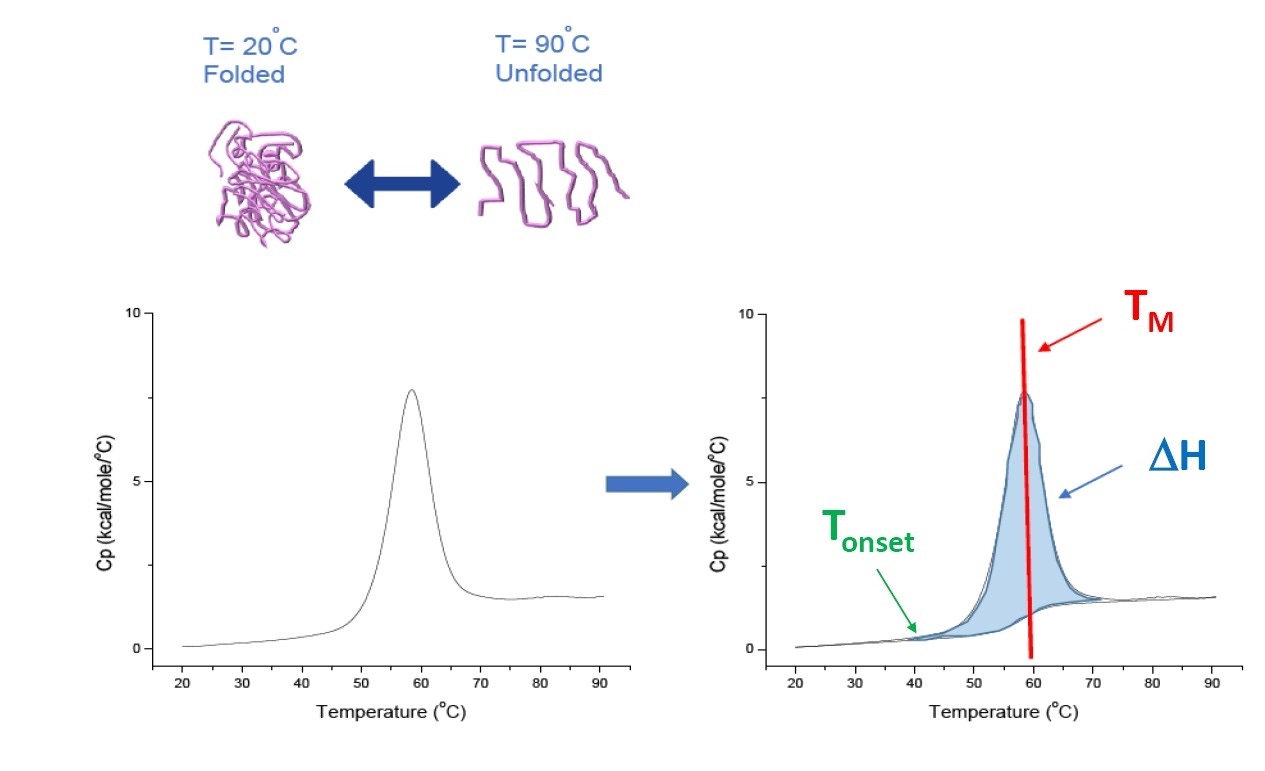
Abbildung 1: Funktionsweise der DSC: Die Wärmekapazität (Cp) ändert sich mit der thermischen Denaturierung des Proteins. Der DSC-Versuch beginnt bei einer Temperatur, bei der das Protein vorwiegend seiner nativen Konformation gefaltet ist. Mit steigender Temperatur beginnt das Protein ab einem bestimmten Punkt sich zu entfalten bzw. zu denaturieren (Tonset), und der Cp-Wert nimmt zu. Bei der Temperatur, bei der 50 % des Proteins in der nativen Konformation vorliegen und 50 % denaturiert sind, erreicht der Cp-Wert sein Maximum. Dies ist der Mittelpunkt des thermischen Übergangs, TM. Oberhalb von TM ist das Protein vorwiegend denaturiert, und zum Ende des DSC-Versuchs liegt das Protein vollständig in entfalteter Konformation vor. Zu den Parametern des DSC-Versuchs gehören Tonset, TM und die Entfaltungsenthalpie (ΔH).
Die DSC misst die Änderung der Wärmekapazität direkt, ohne dass eine Fluoreszenzmarkierung oder eine andere Markierung oder Sonde benötigt wird. Bei reversibel denaturierten Proteinen wird der Mittelpunkt des thermischen Übergangs (TM) auch Schmelz- oder Denaturierungstemperatur genannt. Bei dieser Temperatur befindet sich das Protein in einem konformationellen Gleichgewicht: 50 % liegen in nativer (gefalteter) Konformation und 50 % in denaturierter Konformation vor. Der TM-Wert ist im DSC-Thermogramm als Peak zu erkennen.
TM ist ein guter Indikator für die thermische Stabilität – je höher der TM-Wert, desto thermisch stabiler ist das Protein. DSC-Thermogramme von Multidomänenproteinen (wie z. B. von Antikörpern) weisen typischerweise mehrere Peaks auf, sodass mehrere TM-Werte ermittelt werden können (Beispiel siehe Abbildung 2).
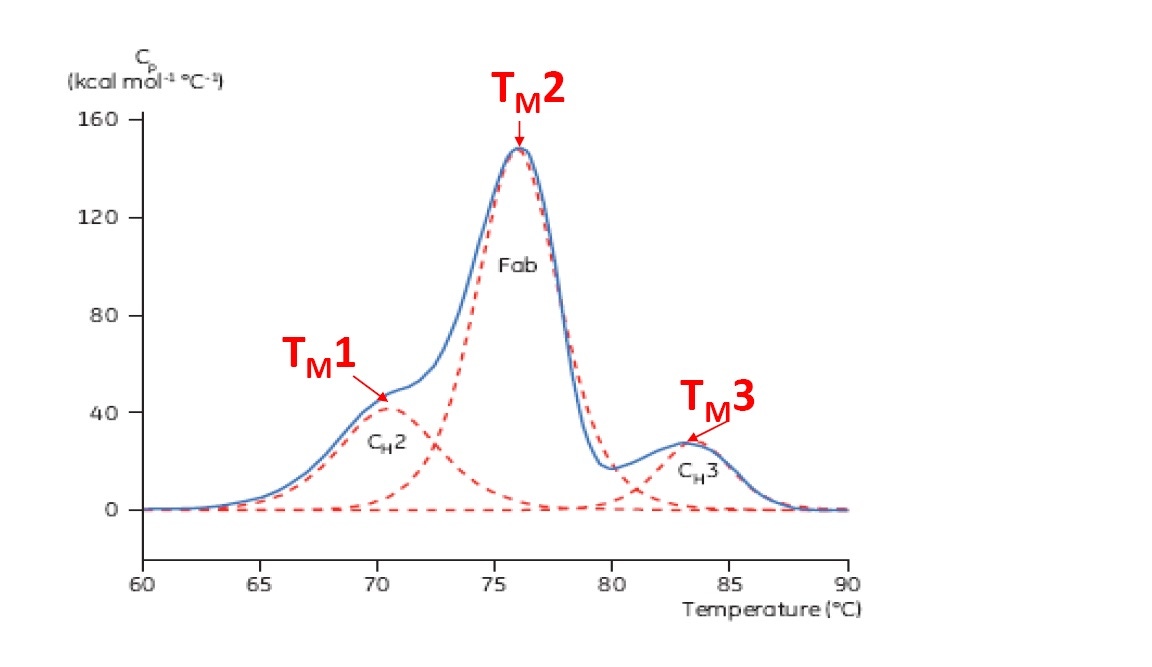
Abbildung 2: Repräsentatives DSC-Thermogramm eines monoklonalen Antikörpers mit Identifikation der CH2-, Fab- und CH3-Domäne. Die gestrichelten roten Linien stellen die dekonvolutierten Peaks der drei einzelnen Domänenübergänge dar. Hierzu sind die jeweiligen TM-Werte gekennzeichnet.
Die DSC liefert auch weitere nützliche Parameter, die zur Charakterisierung und Klassifizierung der Proteinstabilität herangezogen werden können. Hierzu gehört die Entfaltungsenthalpie (ΔH), die proportional zur Fläche unter der Kurve ist. Die Proteinentfaltung ist ein endothermer Vorgang, da eine Energiezufuhr benötigt wird, um die nicht kovalenten sekundären Bindungen aufzubrechen, die das Protein korrekt gefaltet halten. Bestimmt werden können mit der DSC zudem die Werte von Tonset (Beginn der Entfaltung), ΔCp (Wärmekapazitätsänderung bei Entfaltung) und T1/2 (Peakbreite bei halber Peakhöhe, charakteristisch für die Form des Entfaltungsthermogramms). Mittels DSC-Analyse können diese Parameter in beliebiger Kombination bestimmt werden.
Die meisten Proteine denaturieren irreversibel und neigen bei Erhitzung zur Aggregation oder Präzipitation. Der TM-Wert und weitere mittels DSC-Analyse irreversibel denaturierter Proteine bestimmte Parameter sind keine echten thermodynamischen Parameter. Die Klassifizierung der TM-Werte aus der DSC-Analyse einer irreversiblen Proteindenaturierung ergibt jedoch einen sehr nützlichen qualitativen Parameter für Stabilitätsuntersuchungen.
Malvern Instruments liefert das System MicroCal VP-Capillary DSC[8,9], ein automatisiertes DSC-Kalorimeter für TM-Untersuchungen und die thermodynamische Charakterisierung von Proteinen und Biopolymeren in Lösung.
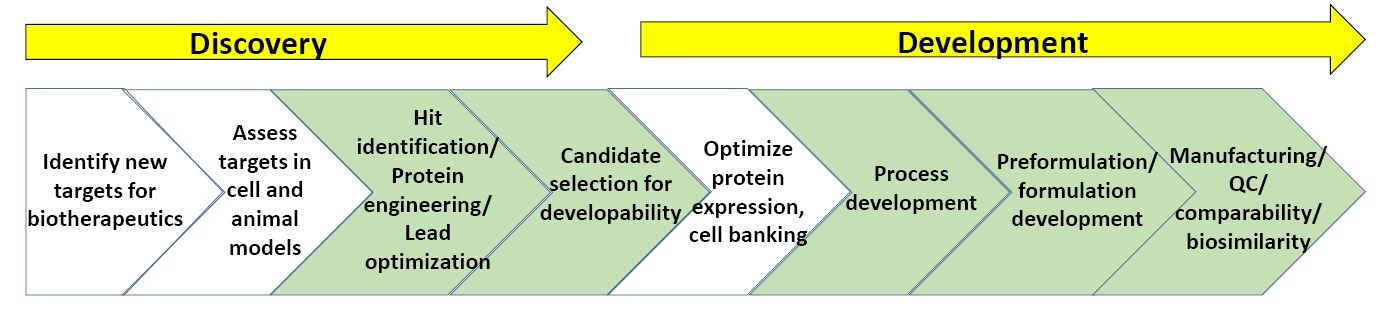
Abbildung 3. Ein allgemeines Schema der Phasen in der Entdeckung und Entwicklung von Biopharmaka.
Abbildung 3 zeigt ein allgemeines Schema der biopharmazeutischen Forschungs- und Entwicklungspipeline. In den grün gekennzeichneten Phasen wird die biophysikalische Charakterisierung (Stabilitätsassays eingeschlossen) am häufigsten eingesetzt. (Am Ende dieses Whitepapers finden Sie eine Liste empfohlener Literatur zur biopharmazeutischen Forschung und Entwicklung).
Die Aminosäuresequenz, die eine Polypeptidkette bildet, wird als Primärstruktur des Proteins (1°) bezeichnet. Darüber hinaus existieren 3 weitere Ebenen der höheren Ordnungsstruktur (HOS), deren Charakterisierung wichtig ist, um die Stabilität, Funktionalität und Aktivität sowie die Gesamteigenschaften des Proteins richtig zu verstehen. Die Sekundärstruktur des Proteins (2°) beschreibt die lokalen Faltungsmuster der Primärstruktur, wie die α-Helix, das β-Faltblatt und statistische Knäuel. Die Tertiärstruktur (3°) beschreibt die endgültige dreidimensionale Struktur eines Proteins, die aus einer Anordnung von Sekundärstrukturelementen gebildet wird. Abschließend beschreibt die Quartärstruktur (4°) die Ergebnisse der Wechselwirkungen zwischen zwei oder mehreren, identischen oder verschiedenen Polypeptidketten.
Biotherapeutika werden meist subkutan verabreicht. Subkutan verabreichte Proteinwirkstoffe müssen bei sehr hohen Proteinkonzentrationen (über 100 mg/ml) in den Behältnissen (z. B. Injektionsfläschchen oder Fertigspritze) stabil und unverändert bleiben – oft über Jahre hinweg. Um ein gewünschtes Biopharmazeutikum zu entwickeln, müssen die Forscher daher zunächst Biomoleküle finden, die bereits bei der Kandidatenauswahl eine hohe Stabilität zeigen. In den Entwicklungs- und Herstellungsprozessen treten jedoch viele Faktoren auf, die die Stabilität eines Moleküls beeinträchtigen können. Die erhöhte Stabilität muss daher u. U. durch Protein-Engineering erzeugt werden.
Der Aufreinigungsprozess umfasst die Entfernung des Proteins aus Bedingungen, in denen es stabil, korrekt gefaltet und aktiv ist. Es ist daher wichtig, Puffer, Additive, Aufreinigungsverfahren und Lagerungsbedingungen sorgfältig anzupassen, um unter diesen Umständen das Protein so stabil wie möglich zu halten. Wenn Proteinmoleküle Stressoren ausgesetzt werden (Wärme, Chemikalien, pH-Änderungen, Druck, Vermischung und hoher Konzentration), wie sie in der Formulierung und Produktion von Biopharmaka häufig auftreten, kann ihre Konformation die denaturierte (entfaltete) Form begünstigen.
Proteine in Lösung sind zudem empfindlich gegenüber Modifikationen wie Deamidierung und Oxidation, die zu denaturierten, inaktiven Proteinen führen können. Bei Protein-Biopharmazeutika können eine Denaturation oder andere Modifikationen zur Bildung von Aggregaten führen. Die betroffenen Produkte weisen eine verminderte Wirksamkeit auf oder verlieren ihre Funktion als Wirkstoff. Möglicherweise noch viel wichtiger ist die Rolle, die die Proteinaggregation bei der Verursachung unerwünschter und potenziell lebensbedrohlicher immunogener Reaktionen des Patienten spielt. Dafür gibt es zunehmende Indizien. Die Verwendung inhärent stabiler Proteine führt zu einer kostengünstigeren Produktion und erfolgreichen, wirksamen und sicheren Arzneimitteln.
Die DSC liefert einen detaillierten Überblick über die konformationelle Stabilität sowie über Änderungen der Tertiär- und Quartärstruktur, die auftreten, wenn ein Protein thermisch denaturiert ist. Zudem liefert sie Informationen über die Auswirkung intrinsischer und extrinsischer Faktoren auf die Proteinstabilität. Die DSC gilt als der qualitativ wie quantitativ beste Assay für die Charakterisierung der thermischen Stabilität von biopharmazeutischen Proteinen. Sie wird häufig zur Vorhersage der Langzeitstabilität eingesetzt.[1,10-14] Die mittels DSC ermittelten TM-Werte werden häufig als Parameter herangezogen, um die Stabilität bei der Kandidatenauswahl (Entwicklungsfähigkeit), beim Formulierungsscreening und bei der Verfahrensentwicklung zu klassifizieren. Auch die mittels DCS gemessenen Größen Enthalpie (ΔH), Tonset, T1/2 und ΔCp werden für die Stabilitätsklassifizierung, die Validierung von DSC-Daten, die quantitative Analyse der Proteinentfaltung und das HOS-Fingerprinting verwendet.[10-14]
DSC-Analysen von sehr ähnlichen Proteinen unter definierten Lösungsbedingungen sind reproduzierbar und quantitativ (Abbildung 4). Das heißt, die DSC-Thermogramme weisen ähnliche Profile auf und die Parameter (einschließlich TM, ΔH und Tonset) liegen innerhalb eines bestimmten Streubereichs.[12-14] Falls die Thermogramme unterschiedlich aussehen und sich die mittels DSC ermittelten Parameter ändern, weist dies auf ein Ereignis hin, wie Proteinfehlfaltung, Degradation, Aggregation, Pufferunterschiede, Änderungen der posttranslationalen Modifikation oder andere Änderungen der höheren Ordnungsstruktur, die sich auf die konformationelle Stabilität des Proteins auswirken.
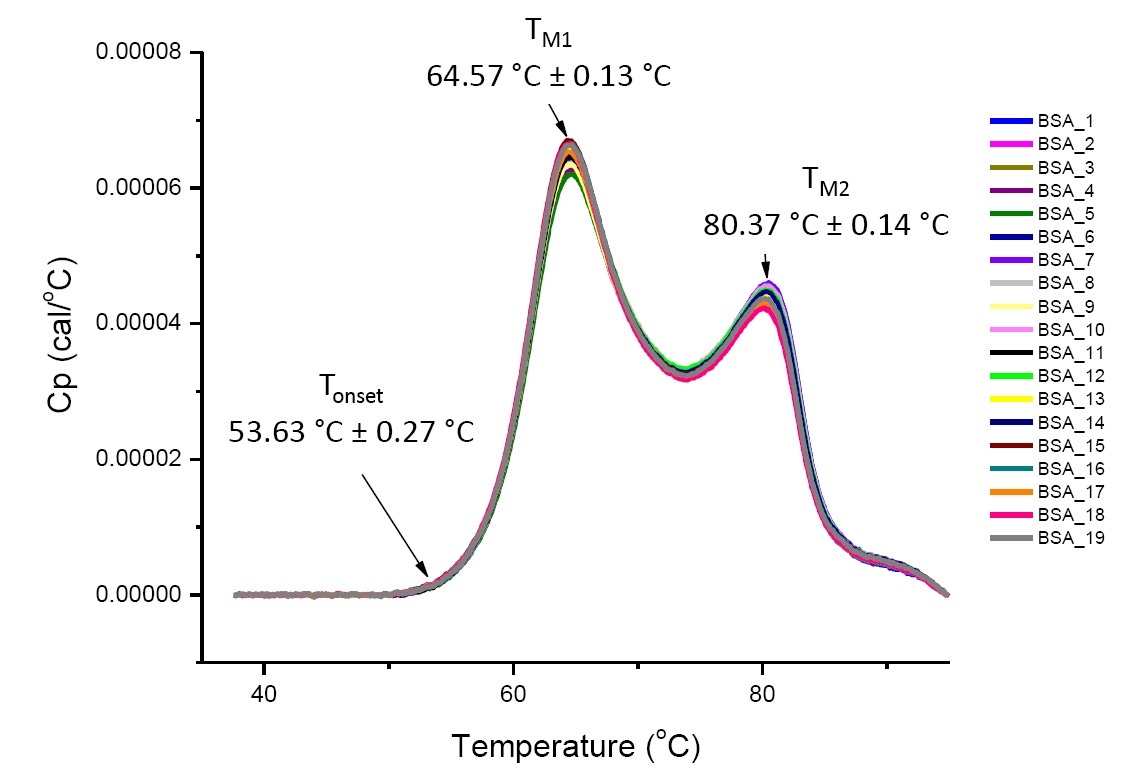
Abbildung 4: Neunzehn DSC-Thermogramme von Rinderserumalbumin (Sigma A1933, chromatographisch gereinigt) in PBS. Auftrag der DSC-Daten nach Normalisierung der Durchlaufrate, Puffer-Puffer-Subtraktion, Integration und Basisliniensubtraktion. Angegeben sind Mittelwert und Standardabweichung von Tonset, TM1 und TM2.
Aufgrund der reproduzierbaren und quantitativen Ergebnisse ist die DSC ein wertvolles HOS-Charakterisierungswerkzeug. Eingesetzt werden kann sie für die Produktevaluierung bei der Herstellung (einschließlich von Chargen- und Standortvergleichbarkeit), den Vergleich von Proteinvarianten und modifizierten Produkten (einschließlich von strukturellen Veränderungen durch Glykosylierung, Deamidierung und Oxidation) und Biosimilaritätsstudien. Als Bestandteil der HOS-Charakterisierung finden DSC-Daten auch Eingang in Dokumente im regulatorischen Umfeld im Rahmen der Zulassung neuer Wirkstoffe und Biosimilars. Bei einer Befragung von biopharmazeutischen Forschern stuften diese die DSC als „sehr hilfreiches“ bis „äußerst hilfreiches“ biophysikalisches Analyseverfahren bei Kandidatenauswahl, Formulierungsentwicklung, Produktcharakterisierung sowie Vergleichbarkeits- und Biosimilaritätsstudien ein.[15]
Die TM-Werte können sehr einfach anhand der Peaks im DSC-Thermogramm bestimmt werden, ohne dass eine komplexe Datenanalyse notwendig ist. Wie vorstehend gezeigt (Abbildung 2), weisen die DSC-Thermogramme von Multidomänenproteinen, wie z. B. von Antikörpern, mehrere Entfaltungsübergänge auf. Mit der DSC können die einzelnen Domänen charakterisiert und quantifiziert werden. Ebenso können die TM-Werte für zwei, drei oder mehr Übergänge bestimmt werden. Andere biophysikalische Assays zur Bestimmung der TM-Werte, wie z. B. CD, IF und DSF, können bei Multidomänenproteinen nur den ersten TM-Wert detektieren (der bei der niedrigsten Temperatur auftritt) oder den „dominantesten“ TM-Wert. Um aus spektroskopischen Daten oder Fluoreszenzdaten mehr als einen TM-Wert zu extrahieren; werden komplexe Datenanpassungen benötigt. Zudem ist diese Bestimmung u. U. nicht reproduzierbar.
Im Vergleich zu anderen Assays zur TM-Bestimmung wird für die DSC häufig mehr Proteinprobenmaterial pro Durchlauf benötigt. Zudem kann der Durchsatz geringer ausfallen. Bei begrenzter Probenmaterialmenge kann daher zunächst eine TM-Klassifizierung mittels DSF oder IF durchgeführt werden. Anschließend können mehrere Schlüsselproben ausgewählt werden, um die TM-Werte mittels DSC zu validieren. Wichtig ist, dass dieser DSC-Validierungsschritt erfolgt und dass die Messung der TM-Werte in Stabilitätsassays nicht allein auf das Fluoreszenz- oder Spektroskopieverfahren beschränkt bleibt. Fluoreszenzbasierte Assays werden häufig durch Artefakte beeinträchtigt. Diese stören die Messungen und bewirken eine Verschiebung der TM-Werte zu höheren (oder niedrigeren) Temperaturen. Manche Proteine und Pufferbedingungen sind zudem nicht kompatibel mit Fluoreszenzverfahren, wodurch DSF und IF ungeeignet werden. Und schließlich können mit Fluoreszenz- oder Spektroskopieverfahren nicht die kalorimetrische Enthalpie und andere thermodynamische Parameter bestimmt werden, die von der DSC geliefert werden.
Die DSC wird von Forschern in der biopharmazeutischen Industrie als maßgeblicher Thermostabilitätsassay erachtet, weil das Verfahren folgende Vorteile hat:
Es misst die mit der Proteinentfaltung einhergehenden Wärmeänderungen.
Es ermöglicht eine direkte Messung der Proteinentfaltung, ohne dass eine Markierung, eine Sonde oder ein Tag notwendig ist. (Daher wird die DSC nicht von Detektionsartefakten beeinträchtigt, wie sie bei Fluoreszenzassays oder anderen spektroskopischen Assays üblich sind.)
Es ist auf native Proteine in Lösung anwendbar.
Es kann mit nahezu allen Puffern und Additiven eingesetzt werden, die in der Aufreinigung und Formulierung von Biopharmaka üblich sind. Demgegenüber sind viele dieser Puffer und Additive nicht kompatibel mit Fluoreszenz- oder Spektroskopieverfahren.
Es ist einfach einzurichten und zu bedienen.
Es weist eine hochpräzise Temperaturregelung mit einem Arbeitsbereich bis 130 °C auf, sodass es auch Übergänge mit sehr hohen TM-Werten detektieren kann. Bei den meisten anderen Assays zur TM-Bestimmung werden die Proben nur bis auf 100 °C (oder weniger) erhitzt.
Es handelt sich um einen „Forced-Degradation-Assay“, bei dem das Protein nicht vor der Analyse in erwärmten Pufferlösungen gelagert werden muss.
Es verfügt über eine einfache Dateiausgabe und eine integrierte Datenanalysesoftware.
Es kann zur Auflösung separater Entfaltungsübergänge und zur Charakterisierung von Multidomänenproteinen, Proteinkomplexen und einfachen Einzeldomänenproteinen eingesetzt werden.
Es ist aussagekräftig und liefert thermodynamische Daten zusätzlich zur Bestimmung der konformationellen Stabilität und der TM-Werte.
Es kann als Primärassay zur Charakterisierung der thermischen Stabilität von Biotherapeutika dienen. Zudem kann es auch zusammen mit anderen orthogonalen/komplementären biophysikalischen Screening-Methoden sowie zur Validierung anderer Daten verwendet werden.
Es ist in einer automatisierten Version mit hohem Durchsatz erhältlich (MicroCal VP-Capillary DSC Automated), um schnelle Untersuchungen der thermischen Stabilität durchzuführen.
Wenn ein proteinbasierter Wirkstoff den Weg von der Entdeckung bis zur Entwicklung durchläuft, ist es entscheidend, eine geeignete, wirksame und optimale Formulierung zu entwickeln. Diese muss ihre Stabilität, Konformation und Wirksamkeit beim Transport, im Einsatz und während der gesamten gewünschten Haltbarkeitszeit beibehalten. Die Formulierung muss kostengünstig herzustellen sein. Gefragt sind Proteinformulierungen, die vom Patienten bequem selbst verabreicht werden können. Hierzu muss der Wirkstoff als Fertigspritze oder in einer ähnlichen Darreichungsform geliefert und gelagert werden, die nicht die Hilfe einer medizinischen Fachkraft voraussetzt. Zudem muss die Lagerung des Wirkstoffs bei Umgebungstemperatur oder im Kühlschrank möglich sein. Bestimmte Biopharmazeutika können auch in lyophilisierter Form (gefriergetrocknet) ausgeliefert werden. In diesem Fall muss der Wirkstoff vor Verabreichung aufgelöst werden.
In der frühen Phase der Entwicklung ist das für Prüfungen verfügbare Probenvolumen oft begrenzt. Daher führen manche Unternehmen eine Präformulierungsentwicklung durch. Sie umfasst anfängliche, kleinere biophysikalische Studien, um die optimalen Pufferzusammensetzungen und pH-Werte zu bestimmen, die zur Stabilisierung des Proteins beitragen. Diese Arbeitsschritte helfen dabei, eine Formulierung zu finden, in der der Proteinwirkstoff schließlich in die vorklinischen und klinischen Studien übernommen wird. Die Präformulierungsentwicklung kann parallel zur Kandidatenauswahl für die Beurteilung der Entwicklungsfähigkeit von Wirkstoffen erfolgen. Viele der biophysikalischen Prüfungen sind nämlich in beiden Evaluierungen identisch.
Während der Präformulierungsentwicklung und der nachfolgenden Formulierungsentwicklung für einen Proteinwirkstoff ist das Protein unterschiedlichen Bedingungen ausgesetzt. Hierzu gehören:
Unterschiedliche Puffer, pH-Werte und Salzkonzentrationen
Unterschiedliche Formulierungsadditive (Hilfsstoffe). Hilfsstoffe sind inerte Stoffe, die in flüssigen und lyophilisierten Formulierungen zur Stabilisierung des Proteins beitragen oder die Herstellung oder Wirkstofffreigabe unterstützen. Zu den bei biopharmazeutischen Produkten häufig eingesetzten Hilfsstoffen gehören Netzmittel (z. B. Polysorbat 80), Zucker (z. B. Trehalose), Polyole (z. B. Glycerin), Aminosäuren, Konservierungsstoffe und Antioxidantien.
Hohe Proteinkonzentrationen, um zu messen, wie stark ein Wirkstoff konzentriert werden kann (mit verschiedenen Puffern und Additiven), bevor eine Proteinaggregation auftritt.
Extreme Temperatur-, Druck- und Feuchtebedingungen
Wiederholte Gefrier- und Auftauzyklen sowie Erschütterungen (z. B. in Gegenwart von Luft-Flüssigkeits-Grenzschichten oder durch Transportbelastungen)
Kontakt mit unterschiedlichsten Materialoberflächen, darunter auch Testmuster der Endbehältnisse (z. B. Injektionsfläschchen, Fertigspritze, IV-Beutel)
Unterschiedliche Lichtstärken
Oxidantien
Echtzeit-Lagerungsversuche (zur Bewertung der potenziellen Langzeitstabilität des Arzneimittels wird es unter den vorgesehenen Lagerungsbedingungen zwei Jahre lang aufbewahrt – der typischen Haltbarkeitsdauer entsprechend) und beschleunigte Belastungsprüfungen bei erhöhten Temperaturen
Ein Artikel aus dem Jahr 2016 von Kang et al.[16] beschreibt die Evaluierung von 37 Formulierungen, die erfolgreich für kommerzielle monoklonale Antikörper eingesetzt wurden. Aus der Zusammenfassung der Evaluierung:
Von den Formulierungen lagen 12 in lyophilisierter Form und 25 in flüssiger Form vor (in Konzentrationen zwischen 2 mg/ml und 200 mg/ml).
Zu den Hilfsstoffen gehörten Salze, Netzmittel, Polyole, Disaccharide, Polysaccharide, Aminosäuren und Antioxidantien.
Um einen optimalen pH-Wert (zwischen 4,7 und 7,4) aufrechtzuerhalten, wurden vor allem Acetat-, Citrat-, Histidin-, Phosphat- und TRIS-Puffer eingesetzt.
Für die meisten Formulierungen wurde eines von drei Netzmitteln verwendet: Polysorbat 80 (Tween 80), Polysorbat 20 (Tween 20) und Poloxamer 188.
Alle lyophilisierten Formulierungen und 30 % der flüssigen Formulierungen enthielten Zucker (Polyole/Disaccharide/Polysaccharide).
Auch NaCl wurde häufig zugegeben.
Glycin und Arginin gehörten zu den häufig verwendeten Aminosäure-Trägerstoffen.
Ein Protein in wässriger Lösung befindet sich im Gleichgewicht zwischen seiner nativen (gefalteten) und denaturierten (ungefalteten) Konformation. Hydrophobe Wechselwirkungen und Wasserstoffbrücken sind die wichtigsten stabilisierenden Kräfte bei Proteinen. Diese müssen überwunden werden, damit sich ein Protein entfalten und denaturieren kann. Die konformationelle Entropie schwächt diese stabilisierenden Kräfte, wodurch die Entfaltung des Proteins möglich wird. Bei der Formulierungsentwicklung geht es primär darum, herauszufinden, welche Lösungsbedingungen die beste Stabilisierung des nativen Proteins bieten, sodass dessen Anteil maximiert werden kann. Denaturierte Proteine sind anfälliger für irreversible chemische Prozesse, wie Proteolyse, Oxidation und Deamidierung, die wiederum zur Inaktivierung und Aggregation führen können.
Biophysikalische Charakterisierungswerkzeuge dienen zur Überwachung der Proteinkonformation, zur Vorhersage der thermischen Stabilität und zur Messung der Aggregatbildung in Reaktion auf Formulierungs- und Lagerungsbedingungen. Von den in den vorherigen Abschnitten dieses Whitepapers beschriebenen biophysikalischen Werkzeugen gehören viele zum Workflow der Präformulierungs- und Formulierungsentwicklung. Zu diesen Werkzeugen gehören DSC, DSF, DLS, SLS, CD und IF. Evaluiert werden anhand dieser Assays die Stabilität der Proteinkonformation (durch Bestimmung von TM, von Tonset und des DSC-Thermogrammprofils), die HOS, die Partikelgröße und die Aggregatbildung.
Die Klassifizierung der TM-Werte mittels DSC wird üblicherweise für ein erstes Screening von Formulierungs-pH-Wert, Puffern und Hilfsstoffen eingesetzt. Je höher der gemessene TM-Wert, desto stabiler ist in der Regel das Protein in der Formulierung (siehe DSC-Thermogramme für das pH-Screening eines Proteins in Abbildung 5) und desto unwahrscheinlicher ist eine Aggregatbildung während der Lagerung (siehe nachfolgende Fallstudien). Die DSC ist mit nahezu allen Puffern und Hilfsstoffen kompatibel, die in biopharmazeutischen Formulierungen verwendet werden. Selbst wenn die thermischen Übergänge eines Proteins irreversibel sind, ist die DSC ein praktisches und schnelles Verfahren zur Klassifizierung der Auswirkungen von Pufferbedingungen und Hilfsstoffen auf die Proteinstabilität während der gesamten Formulierungsentwicklung.
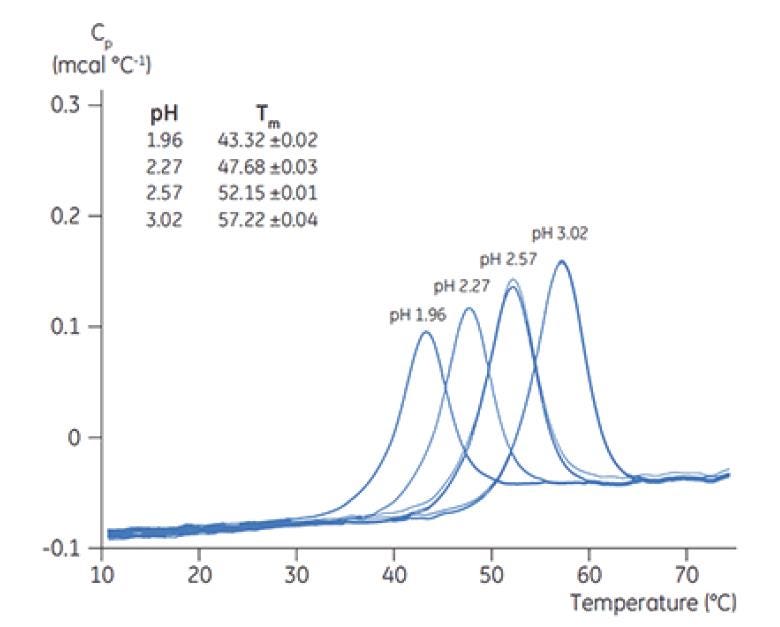
Abbildung 5. DSC-Thermogramme von Chymotrypsinogen bei unterschiedlichen pH-Werten, jeweils mit Angabe des TM-Werts.
Die MicroCal VP-Capillary DSC Systeme werden von einer erheblichen Anzahl von führenden CMOs und CDMOs in der Charakterisierung der konformationellen Stabilität und der Formulierungsentwicklung von Biopharmazeutika eingesetzt. Zu diesen Unternehmen gehören Patheon[16], Fujufilm Diosynth Biotechnologies[17] und KBI Biopharma[18].
Beschleunigte Stabilitätsuntersuchungen (bzw. Belastungsuntersuchungen) sind ein üblicher Bestandteil des Formulierungsscreenings. Dabei wird das Kandidatenmolekül in verschiedenen potenziellen Formulierungen bei erhöhten Temperaturen gelagert. Über einen bestimmten Zeitrahmen erfolgt anschließend mittels SEC, DSC und DLS eine Evaluierung der konformationellen Stabilität, der Größe und der Aggregation sowie potenzieller posttranslationaler Modifikationen.
Sobald der Biopharmaka-Kandidat in der Entwicklungs-Pipeline voranschreitet und eine ausreichende Menge des Proteins verfügbar ist, konzentriert sich die Charakterisierung auf die Prozesse in der endgültigen Formulierung und Produktion sowie auf die potenziellen Auswirkungen der Proteinkonzentration und der Verabreichungssysteme. Zudem werden Langzeitstabilitätsuntersuchungen durchgeführt, um festzustellen, ob der Proteinwirkstoff in der gewählten Formulierung die gewünschte Haltbarkeit und Stabilität erzielt. Bei einer geeigneten Formulierung bleibt das HOS-Profil des Biopharmazeutikums mindestens zwei Jahre lang erhalten.
Es kann nicht garantiert werden, dass die thermische Stabilität stets mit der physikalischen Stabilität eines Proteins während der Lagerung korreliert. Doch ein höherer TM-Wert weist in der Regel darauf hin, dass zur Entfaltung des Proteins mehr Energie benötigt wird. Wenn alle anderen Eigenschaften des Proteins vergleichbar sind, ist die Proteinformulierung vorzuziehen, die eine bessere thermische Stabilität bietet.
In einer Veröffentlichung aus dem Jahr 1998 von Remmele et al.[19] wird der Einsatz eines MicroCal DSC zur Charakterisierung der thermischen Stabilität eines rekombinanten humanen Interleukin-1-Rezeptors vom Typ 1 (IL-1R) in Puffern mit unterschiedlichen Hilfsstoffen beschrieben. Eine beschleunigte Stabilitätsuntersuchung (bei 30 °C und 50 °C), bei der IL-1R in Lösungen mit pH-Werten von 3 bis 9 gelagert wurde, zeigte eine minimale Proteindegradation und Aggregation bei pH 6 (mittels SDS-PAGE). Das DSC-Thermogramm für IL-1R in der Kontrolllösung (20 mM Natriumcitrat, pH 6,0) zeigte den ersten TM-Peak bei 48 °C und den zweiten TM-Peak bei 65,5 °C. Es wurden 23 unterschiedliche Hilfsstoffe getestet. Zu diesen gehörten Zucker (Mannitol, Lactose, Saccharose und Glucose), Polyole (Polyethylenglycol, Glycerin und Ethanol), Netzmittel (Tween 80, Pluronic F68), Salze (NaCl und CaCl2) und Aminosäuren (Lysin, Cystein, Alanin, Arginin und Glycin). Der zweite TM-Wert wurde durch die Hilfsstoffe nicht beeinflusst. Daher wurde die Temperatur des ersten thermischen Übergangs zur Klassifizierung der Stabilität herangezogen. Die Strategie bestand in der Suche nach Hilfsstoffen, die eine Erhöhung des TM-Werts des Übergangs niedriger Temperatur bewirken, entsprechend einer positiven Veränderung der Stabilität des nativen Proteins. Von den getesteten Hilfsstoffen bewirkten die meisten eine Absenkung des TM-Werts (die auf eine Destabilisierung von IL-1R hinweist) oder eine geringfügige Anhebung. Der Hilfsstoff, der die größte Anhebung von TM bewirkte (die auf eine verbesserte konformationelle Stabilität hinweist), war 100 mM NaCl. Dabei wurde der erste TM-Peak von 48,1 °C auf 53,1 °C angehoben. Die Autoren überprüften, wie sich eine weitere Erhöhung der NaCl-Konzentration von 100 mM auf 1500 mM auf die Anhebung des TM-Peaks auswirkte. Aus den Ergebnissen schlossen die Autoren, dass die erhöhte thermische Stabilität von IL-1R in Gegenwart von NaCl sowohl auf die direkten Wechselwirkungen von NaCl mit dem Protein als möglicherweise auch auf Veränderungen der Wasserstruktur zurückzuführen war. Es wurden weitere Hilfsstoffanalysen in Gegenwart von 100 mM NaCl durchgeführt.
In derselben Studie haben die Autoren auch die Auswirkungen von Konservierungsstoffen auf die Stabilität und Aggregation von IL-1R untersucht. Konservierungsstoffe werden für Mehrfachdosis-Formulierungen verwendet. Untersucht wurden Benzylalkohol, m-Cresol und Phenol. Die DSC-Thermogramme zeigten, dass IL-1R durch alle drei Konservierungsstoffe destabilisiert wurde. Dabei hatte Phenol die geringsten Auswirkungen auf die thermische Stabilität, während Benzylalkohol die größte destabilisierende Wirkung auf die TM-Werte zeigte. Diese Ergebnisse wurden mittels SEC-Analyse der Aggregationsbildung nach einer Lagerung bei 37 °C über 7 und 60 Tage verifiziert. Die Phenol enthaltenden Proben wiesen den niedrigsten Aggregationsgrad auf, während die mit Benzylalkohol inkubierten Proben den höchsten Aggregationsgrad aufwiesen.
Remmele und Gombotz[20] zeigten, dass die Messung des TM-Werts mittels DSC einen guten Indikator für die Aggregation von CD40L ergab. Bei pH-Stabilitätsuntersuchungen mittels DSC wurden die höchsten TM-Werte zwischen pH 6 und pH 7,5 gefunden. Dies korrelierte mit dem pH-Bereich, in dem mittels SEC die niedrigste Aggregationsbildung gemessen wurde (nach Lagerung bei 37 °C über 7 Tage).
Remmele[11] fasst andere Studien zusammen, in denen die Stabilität von Protein (z. B. Chymotrypsinogen und Pepsinogen) in einer Vielzahl von Formulierungen anhand von Daten aus DSC-Thermogrammen vorhergesagt und klassifiziert wurde. Remmele erörtert zudem, inwieweit der Einsatz der DSC in Verbindung mit anderen Analyseverfahren (SEC-HPLC, CD, AUC, DLS, MS) Rückschlüsse auf die konformationelle Stabilität des Biopharmazeutikums in unterschiedlichen Formulierungen ermöglicht. Anhand solcher Informationen kann dann entschieden werden, mit welcher Formulierung fortgesetzt wird.
Auch andere Studien zum Formulierungsscreening kommen zu dem Ergebnis, dass Formulierungen mit hohen TM-Werten (gemessen mittels DSC) tendenziell niedrigere Aggregationsgrade aufweisen, wenn sie mittels beschleunigter Stabilitätsuntersuchungen und SEC-HPLC evaluiert werden.[21-25]
Burton et al.[26] haben die Verwendung der DSC als schnelles Screening-Werkzeug zur Beurteilung der Stabilität von zwei rekombinanten Modellantikörpern bewertet. Veränderungen des TM-Werts wurden in Abhängigkeit vom pH-Wert und/oder von Hilfsstoffen aufgezeichnet. Die Ergebnisse wurden mit beschleunigten Stabilitätsdaten von Proben verglichen, die mittels SEC analysiert wurden. Die vom MicroCal DSC generierten Daten korrelierten mit denen der SEC. Proben mit höheren TM-Werten (gemessen mittels DSC) wiesen zugleich die niedrigsten Aggregationsgrade auf (gemessen mittels SEC). Somit konnten mittels DSC sowohl der optimale Lösungs-pH-Wert als auch die Auswirkungen der Hilfsstoffe auf die Lösungsstabilität bestimmt werden. Die pH-Werte, für die mittels DSC maximale Stabilitätswerte vorhergesagt wurden, betrugen pH 7,5 für Protein I und pH 6 für Protein II. Diese Werte stimmten weitgehend mit den Vorhersagen aus Langzeituntersuchungen der Lösungsstabilität beider Proteine überein. In der Schlussfolgerung des Artikels schreiben die Autoren: „Die Ergebnisse dieser Untersuchungen belegen, dass die Mikrokalorimetrie ein wertvolles Werkzeug für schnelle Untersuchungen der Proteinstabilität in Lösung ist. Dies gilt insbesondere für die frühe Phase der Proteincharakterisierung und Formulierungsentwicklung, wenn die zur Verfügung stehenden Mengen oft sehr begrenzt sind. [...] Sie kann erhebliche Einsparpotenziale hinsichtlich der erforderlichen Wirkstoffmengen als auch hinsichtlich des Zeit- und Arbeitsaufwands für die Probenvorbereitung und die komplexe Analyse erschließen.“[26]
In einer Malvern Instruments Application Note wird gezeigt, wie Dr. Katherine Bowers (Fujifilm Diosynth Biotechnologies) die DSC in der Präformulierungsentwicklung einsetzt.[27] Der Antikörper X wurde in verschiedene Puffer mit pH-Werten zwischen 3 und 8 eingebracht. Es folgte eine DSC-Analyse (mit dem MicroCal VP-Capillary DSC), die sowohl unmittelbar (bei t = 0) als auch nach einer Lagerung über 1 Woche durchgeführt wurde.
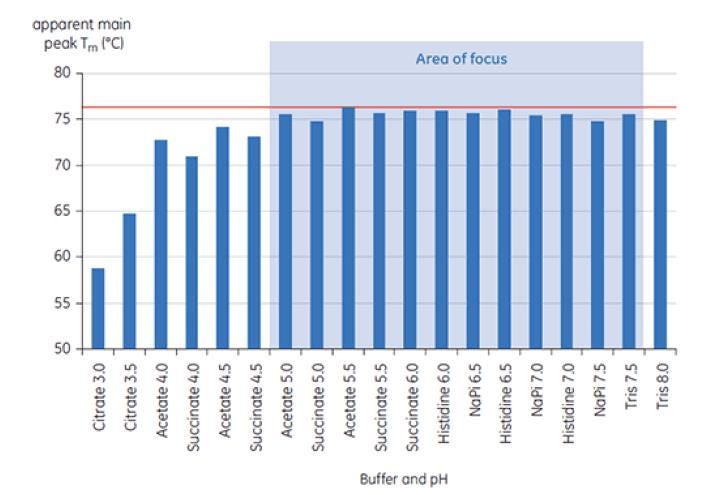
Abbildung 6: Bereich der TM-Werte von Antikörper X in Präformulierungspuffern. Die Analyse der Proben erfolgte mit dem MicroCal VP-Capillary DSC bei t = 0.
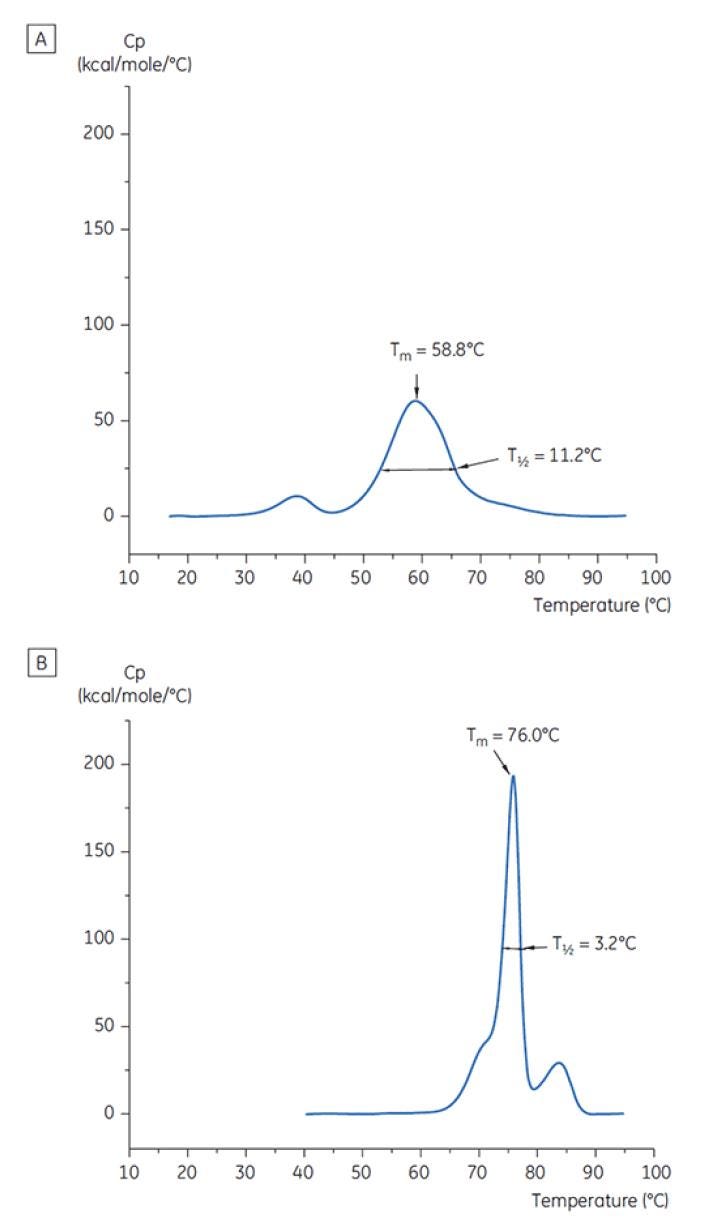
Abbildung 7: DSC-Thermogramme von Antikörper X bei t = 0. (A) gelöst in Citratpuffer, pH 3,0; (B) gelöst in Succinatpuffer, pH 6,0. Für beide Puffer sind die TM- und T½-Werte gezeigt.
Abbildung 6 zeigt die Werte der TM-Hauptpeaks bei t = 0 für Antikörper X im ersten Präformulierungsscreening. Abbildung 7 zeigt das Thermogramm für Antikörper X in Citratpuffer (pH 3) und Succinatpuffer (pH 6). Aus den gemessenen TM-Werten konnten die stabilsten Pufferbedingungen (mit den höchsten TM-Werten) bei pH-Werten zwischen 5,0 und 7,5 bestimmt werden. Bei t = 0 ergaben andere analytische Verfahren (UV, Größenausschlusschromatographie (SEC), Lichtstreuung und SDS-PAGE) gegenüber der DSC deutlich weniger Unterschiede zwischen den Pufferbedingungen.
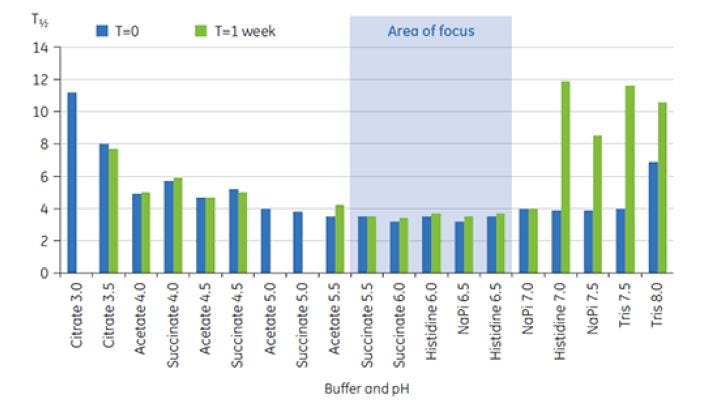
Abbildung 8: Bereiche der T½-Werte für den TM-Hauptübergang von Antikörper X in Präformulierungspuffern bei t = 0 und t = 1 Woche.
Eine weitere Unterscheidung der Formulierungsbedingungen erfolgte anhand der T½-Werte (siehe Abbildung 8). Der T½-Wert entspricht der Peakbreite des Hauptübergangs im DSC-Thermogramm bei halber Maximalhöhe. Er spiegelt in der Regel die Kooperativität des thermischen Übergangs wider. Ein niedriger T½-Wert kann auf eine kompaktere Struktur hinweisen und wird daher für Formulierungen bevorzugt. Nach einer Lagerung über 1 Woche wurden die niedrigsten T½-Werte bei Puffern mit pH-Werten zwischen 5,5 und 6,5 ermittelt (Abbildung 8). Anhand dieser Daten wurden geeignete Puffer und pH-Bereiche für das nachfolgende Hilfsstoffscreening klassifiziert, wodurch die Anzahl der zu untersuchenden Bedingungen erheblich verringert werden konnte. Diese Untersuchung zeigt, dass die DSC zur schnellen Optimierung von pH-und Pufferbedingungen für die Präformulierungsentwicklung eingesetzt werden kann.
Ein biopharmazeutisches Produkt wird auch in verschiedenen Puffern und Hilfsstoffen charakterisiert, um die potenziellen Proteindegradationswege zu verstehen. Diese Informationen helfen bei der Entwicklung der endgültigen Formulierung. In der Regel degradieren biopharmazeutische Wirkstoffe nicht, wenn sie während der Formulierungsentwicklung im Kühlschrank gelagert werden. Daher wird üblicherweise eine durch Temperaturerhöhung beschleunigte Stabilitätsuntersuchung durchgeführt, wie oben in mehreren Beispielen erörtert. In einer Studie von Zheng et al.[28] wurde die Degradation eines therapeutischen monoklonalen IgG1-Antikörpers mAb-A untersucht. Diese Forschungsgruppe evaluierte mAb-A zunächst in unterschiedlichen Puffern (Natriumphosphat, Natriumcitrat und Natriumacetat), bei unterschiedlichen NaCl-Konzentrationen (20 mM und 100 mM) und bei unterschiedlichen pH-Werten (pH 4,5; 5,5; 6,5 und 7,5) mit einem MicroCal VP-Capillary DSC. Die vielversprechendsten Formulierungskandidaten aus den einzelnen Puffergruppen (d. h. diejenigen mit den höchsten TM- und Tonset-Werten) wurden zur weiteren Evaluierung ausgewählt: Natriumphosphat mit pH 6,5 plus 20 mM NaCl, Natriumcitrat mit pH 6,5 plus 20 mM NaCl und Natriumacetat mit pH 6,5 plus 20 mM NaCl. In diesen drei Puffern zeigte mAb-A ähnliche TM- und Tonset-Werte sowie nahezu identische DSC-Thermogrammprofile. Zum Vergleich wurde in dieser Studie auch eine Formulierung in Natriumacetat mit pH 4,5 plus 20 mM NaCl untersucht, die einen niedrigeren thermischen Übergang bzw. TM-Wert aufwies.
Die Autoren lagerten mAb-A in den vier Formulierungen bei 40 °C. Anschließend wurden die Proteine weitergehend charakterisiert. Eingesetzt wurden hierzu die Verfahren SEC (zur Trennung der Degradationsprodukte vom nativen Protein), DLS (zur Bestimmung des modifizierten zweiten Virialkoeffizienten für die Charakterisierung der Protein-Protein-Interaktionen), LC-MS (zur Sequenzierung der Degradationsprodukte), hydrophobe Interaktionschromatographie (zur Trennung der Degradationsprodukte vom nativen Protein) und SDS-PAGE (zur Bestimmung der Molekulargewichte der Degradationsprodukte). Es wurde festgestellt, dass eine Lagerung in einem Puffer bei pH 4,5 eine stärkere Fragmentierung bewirkte als eine Lagerung im gleichen Puffer bei pH 6,5. Des Weiteren wurde durch eine Lagerung bei pH 4,5 die Entfaltung der CH2-Domäne induziert. Möglicherweise wurde durch Erhöhung der Oberflächenzugänglichkeit von mAb-A eine Fragmentierung begünstigt. Wenngleich mittels DSC gezeigt wurde, dass die konformationelle Struktur von mAb-A in Phosphatpuffer mit pH 6,5, Citratpuffer mit pH 6,5 und Acetatpuffer mit pH 6,5 ähnlich war, ergab die DLS-Messung, dass die Stärke der Protein-Protein-Interaktion bei den einzelnen Puffern unterschiedlich war. In der Zusammenfassung zeigten die Ergebnisse dieser Studie, dass die Protein-Protein-Interaktionen bei der Kontrolle der Aggregatbildung in mAb-A eine zentrale Rolle spielten. Die Autoren gaben ferner an, dass die aus dieser Studie gewonnenen Erkenntnisse hilfreich für die Formulierungsentwicklung für mAb-A waren, jedoch nicht auf andere monoklonale Antikörper übertragen werden sollten.
Die Proteolyse von Biopharmazeutika bei der Aufreinigung und Lagerung kann ein weiteres Problem darstellen. Wirtszellproteasen können die Qualität rekombinanter Proteine beeinträchtigen und auch signifikante Produktverluste verursachen. Entfaltete oder partiell gefaltete Proteine sind anfälliger für Proteolyse als gefaltete Proteine. Gefaltete Proteine können durch Zugabe von Osmolyten gegen Proteolyse stabilisiert werden.
In einer Studie von Mueller et al.[29] wurde der Schutzmechanismus eines IgM-Antikörpers gegen Proteolyse untersucht. IgM-Antikörper kommen zunehmend als therapeutische Kandidaten in Betracht. Sie gelten jedoch als inhärent instabil. In dieser Studie wurden die Proteasen Pepsin, Papain und α-Chymotrypsin einem gereinigten IgM-Antikörper (mAb 85) zugegeben. Anschließend wurde die Degradation in Abwesenheit und in Gegenwart von Hilfsstoffen analysiert. Eine Erhöhung der konformationellen Stabilität von mAb 85 infolge einer Zugabe der Hilfsstoffe Glycin und Sorbit wurde mithilfe des MicroCal VP-Capillary DSC bestätigt. In Abhängigkeit vom pH-Wert des Puffers trat bei mAb 85 eine Entfaltung bei 2 bis 3 thermischen Übergängen auf. Diese Übergänge entsprachen den verschiedenen Domänen oder Strukturbereichen. Eine signifikante Erhöhung der TM-Werte ergab sich durch Zugabe von 20 % Sorbit oder 1 M Glycin (Erhöhung von 4 bis 5 °C) oder beiden Hilfsstoffen (Erhöhung von 7 bis 11 °C) bei pH 5,5 und pH 7,4. Damit stellt sich die Frage, wie der Schutz durch Sorbit und Glycin erfolgt. Eine mögliche Antwort besteht darin, dass die Proteasen durch das Vorhandensein dieser Hilfsstoffe gehemmt werden, u. U. durch eine Kompaktierung ihrer Standardkonformationen. Eine weitere mögliche Antwort besteht in der Kompaktierung des IgM-Antikörpers, durch die dieser für die proteolytische Spaltung weniger zugänglich wird.
Um den Mechanismus aufzuklären, wurde die proteolytische Spaltung von niedermolekularen Substraten untersucht. Diese Substrate werden nicht durch die Kompaktierung ihrer Konformation über den präferenziellen Ausschlussmechanismus stabilisiert. Die Aktivität von Papain war leicht erhöht, während die Aktivität von Chymotrypsin nahezu unverändert blieb. Das lässt darauf schließen, dass die Hilfsstoffe das Papain stabilisieren, ohne seine Aktivität zu verringern. Diese Ergebnisse zeigen, dass die Schutzwirkung der Hilfsstoffe allein auf die konformationelle Stabilisierung von mAb 85 zurückzuführen ist. Damit einhergehen können eine verstärkte Kompaktierung und eine mögliche Verringerung der Zugänglichkeit der Spaltstellen für Proteasen. Durch die Zugabe von Hilfsstoffen wie Sorbit und Glycin zu Puffern bei der Aufreinigung und Formulierung kann daher die Notwendigkeit von Proteaseinhibitoren in biopharmazeutischen Formulierungen verringert oder gar eliminiert werden.
Ein Beispiel für den Einsatz der DSC und anderer biophysikalischer Verfahren in der Formulierungsentwicklung (spezifisch für ein bestimmtes Verabreichungssystem) wird in einem Artikel von Morar-Mitrica et al. beschrieben. [30] Otelixizumab ist ein humanisierter Antikörper (IgG1), der gegen das humane CD3-Antigen gerichtet ist. Da die klinischen Dosen niedrig sind (0,1 mg bis 0,5 mg pro Dosis), wurde der Wirkstoff bei einer Konzentration von 0,2 mg/ml entwickelt. Für die Dosisverabreichung muss der monoklonale Antikörper in einem IV-Beutel mit isotonischer Kochsalzlösung verdünnt werden. Anschließend wird der Inhalt des gesamten Beutels per Infusionspumpe verabreicht. Hierbei ergaben sich im IV-Beutel Proteinkonzentrationen von lediglich 0,002 mg/ml. Aufgrund der niedrigen Proteinkonzentration bestand eine erhöhte Gefahr erheblicher Proteinverluste durch Wechselwirkungen im IV-Beutel und/oder dem Infusionspumpensystem. Mittels konventioneller biophysikalischer Formulierungsentwicklung und In-use-Stabilitätsstudien wurde ein Arzneimittel entwickelt, das verringerte adsorptive Verluste und eine reduzierte oxidative Degradation aufwies und dessen Flüssigformulierung bei Kühlschranktemperaturen stabil war.
Für das standardmäßige Formulierungsscreening wurden die TM-Werte für Otelixizumab in Gegenwart und in Abwesenheit von 0,1 % Polysorbat 80 (PS80) aus den DSC-Thermogrammen bestimmt. Die Thermogramme des Proteins in Gegenwart und in Abwesenheit von PS80 waren ähnlich, bei übereinstimmendem Entfaltungsprofil. Dies lässt darauf schließen, dass keine durch Netzmittel verursachten HOS-Veränderungen vorlagen. Mittels DSC konnten mindestens zwei Spezies/Domänen, die zwei Entfaltungsübergängen entsprachen, eindeutig identifiziert werden. Die DSC-Ergebnisse für den monoklonalen Antikörper in Abwesenheit und in Gegenwart von PS80 zeigten keine signifikanten Unterschiede bei TM1 und TM2. Des Weiteren hatte PS80 keine Auswirkung auf die thermische Stabilität des monoklonalen Antikörpers. Dies zeigte sich anhand eines Vergleichs anderer relevanter thermodynamischer Parameter, die mittels DSC ermittelt wurden, wie T1/2 und der Gesamtenthalpie der Entfaltung.
In Ausgangsstoffen wie Polysorbaten können erhebliche Mengen von Peroxiden vorliegen. Diese können bei biopharmazeutischen Produkten potenzielle oxidative Schädigungen verursachen mit den möglichen Folgen einer verminderten Wirksamkeit und unerwünschter immunogener Reaktionen. Um das Risiko einer Oxidation als bedeutsamen Degradationsweg zu beurteilen, wurde Otelixizumab in reinem Histidinpuffer (ohne PS80) durch Behandlung mit Hydrogenperoxid oxidiert. Anschließend wurden die oxidationsinduzierten strukturellen Veränderungen mittels DSC untersucht und mit einer nicht oxidierten Kontrolle verglichen. Die TM-Analyse zeigte eine oxidationsinduzierte Destabilisierung des ersten Entfaltungsübergangs. Dieser ist üblicherweise der CH2-Domäne des monoklonalen Antikörpers zugeordnet. Es wurde eine signifikante Verringerung des TM1-Werts (des Übergangs niedriger Temperatur) beobachtet, einhergehend mit einer Peakverbreiterung. Der zweite Übergang (TM2) wurde durch die Oxidation nicht beeinflusst. Eine massenspektrometrische Analyse (MS) bestätigte, dass ein exponierter Methioninrest in der CH2-Domäne zu 90 % durch Peroxid oxidiert war. Diese Ergebnisse zeigten, dass die hauptsächliche Oxidationsstelle der Methioninrest in der CH2-Domäne war und dass das Oxidationsereignis mit der thermodynamischen Destabilisierung dieser Domäne korrelierte. Die Autoren kamen zu dem Schluss, dass die Verabreichung niedrig konzentrierter therapeutischer monoklonaler Antikörper nicht trivial ist. Es ist entscheidend, die Formulierungsentwicklung und In-use-Stabilitätsstudien in der frühen Phase der Entwicklung durchzuführen.
Die in diesem Whitepaper vorgestellten Ergebnisse zeigen deutlich die Bedeutung und Effizienz der DSC als biophysikalischer Stabilitätsassay in der Präformulierungs- und Formulierungsentwicklung. Anhand der Ergebnisse der DSC in Verbindung mit anderen Stabilitätsassays können biopharmazeutische Unternehmen fundierte Entscheidungen hinsichtlich der stabilsten Formulierungen treffen. Infolgedessen weist das Protein dann in der endgültigen Formulierung und als Arzneimittel weniger Probleme mit der Langzeitstabilität und Aggregation auf. Daraus ergeben sich eine kostengünstigere Arzneimittelproduktion und eine erhöhte Wahrscheinlichkeit, dass die endgültige Arzneimittelformulierung aktiv, stabil und sicher bleibt und die korrekt gefaltete Konformation beibehält.
Analytical Techniques for Biopharmaceutical Development, R. Rodriguez-Diaz, T. Wehr, S. Tuck (Hrsg.), Taylor & Francis, New York, USA (2005).
Biophysical Characterization of Proteins in Developing Biopharmaceuticals, D.J.Houde, S.A. Berkowitz (Hrsg.), Elsevier, Amsterdam, Niederlande (2015).
Biophysical Methods for Biotherapeutics: Discovery and Development Applications, T.K. Das (Hrsg.) John Wiley & Sons, Hoboken, NJ, USA (2014).
Biophysics for Therapeutic Protein Development, L.O. Nahri (Hrsg.), Springer, New York, USA (2013).
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 1. Monoclonal Antibody Therapeutics: Structure, Function, and Regulatory Space, J.E. Schiel, D.D. Davis, O.V. Borisov (Hrsg.), ACS Symposium Series Vol 1176 (2014). doi: 10.1021/bk-2014-1176.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 2. Biopharmaceutical Characterization: The NIST mAb Case Study, J.E. Schiel, D.D. Davis, O.V. Borisov (Hrsg.), ACS Symposium Series Vol 1201 (2015). doi: 10.1021/bk-2015-1201.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volume 3. Defining the Next Generation of Analytical and Biophysical Techniques, J.E. Schiel, D.D. Davis, O.V. Borisov (Hrsg.), ACS Symposium Series Vol 1202 (2015) doi: 10.1021/bk-2015-1202.