Los datos de DSC se utilizaron para identificar las condiciones de elusión más estabilizadoras para la medida de captura de anticuerpos durante el desarrollo del proceso de una proteína y el resultado en ahorro de costos.
El desarrollo de los procesos biofarmacéuticos puede ser costoso y requerir mucho tiempo. El objetivo principal es maximizar el rendimiento del producto purificado por medio de la ruta más rentable, reproducible y sólida. Ya que las fallas de lotes pueden tener consecuencias económicas significativas, en la comercialización de medicamentos biofarmacéuticos es fundamental contar con una profunda comprensión de la estabilidad de la proteína durante todas las etapas del desarrollo, desde la investigación, pasando por el desarrollo clínico, hasta la fabricación comercial.
Es esencial el mantenimiento de la estabilidad y la preservación de la estructura activa de un producto biofarmacéutico de base proteica hasta su administración. Esto se puede lograr, en parte, por medio de estudios de estabilidad diseñados para comprender el comportamiento físico de los productos bioterapéuticos. Las proteínas generalmente tienen problemas inherentes de inestabilidad, debido a su complejidad y a su delicada estructura. Los estudios de estabilidad para determinar el efecto de diversos factores ambientales que influencian directamente la actividad biológica en la integridad de la conformación de una proteína, tales como el pH, la temperatura, y la fuerza iónica, son indispensables durante el desarrollo del proceso. Estos estudios de estrés ayudan a identificar características fundamentales por medio de la demostración de los puntos débiles de la molécula. Además, proporcionan un enfoque racional para la identificación de mecanismos de desnaturalización y para el desarrollo de contramedidas, mediante la selección de las soluciones amortiguadoras, el pH, la fuerza iónica y los excipientes apropiados.
|
La realización de estudios de estabilidad en paralelo con el desarrollo de un método de purificación permite a los científicos diseñar métodos más eficaces. Durante el desarrollo de procesos de purificación, los estudios de estabilidad pueden:
Los estudios de estabilidad también ayudan en el desarrollo de sólidos ensayos indicadores de estabilidad. Estos datos permiten el desarrollo acelerado de formulaciones para productos farmacológicos, mediante la minimización del rango de condiciones que se necesitan explorar durante estudios de desarrollo de formulación. Esto, a su vez, se traduce en ahorros en recursos, costos y tiempo.
Esta nota de aplicación se centra en la utilidad de la calorimetría diferencial de barrido (DSC) para guiar el desarrollo de procesos de purificación de anticuerpos. En particular, en esta nota se describe cómo se utilizaron los datos de DSC para identificar las condiciones óptimas de elusión durante el desarrollo de captura de la proteína A, que dio lugar a ahorros en los costos en una escala temprana de facturación.
La DSC proporciona una manera de controlar la estabilidad de la proteína por medio del procesamiento y el manejo. Esto puede llevar a mejores condiciones que pueden proteger la molécula cuando se producen condiciones o comportamientos atípicos de la proteína durante el procesamiento o el desarrollo de un ensayo.
Todas las proteínas se prepararon en la solución amortiguadora indicada por diálisis o intercambios de solución amortiguadora con una columna desaladora PD-10 (GE Healthcare). Las concentraciones finales de proteínas fueron de aproximadamente 1 mg/ml. Las proteínas se analizaron con el sistema Malvern MicroCal VP-DSC con un rango de temperatura de 5 °C a 90 °C, a una tasa de barrido de 1 °C por minuto. Se realizaron análisis de los termogramas con el software Origin™ con un modelo de dos estados o uno diferente.
La cromatografía de la afinidad de la proteína A se utiliza comúnmente como el paso de captura inicial para la purificación de un anticuerpo monoclonal. La proteína A se une a la región Fc de diversas moléculas de inmunoglobulina (Ig) del anticuerpo. Esta especificidad y selectividad del enlace puede llevar a la creación de un producto casi puro en un solo paso. Las moléculas de anticuerpos son producidas por cultivos celulares y se deben purificar a partir de proteínas de la célula huésped, ácidos nucleicos y componentes del cultivo celular. Se aplican medios de cultivo de células condicionados libres de células al medio de afinidad de cromatografía de la proteína A. Los anticuerpos se unen a la proteína A inmovilizada a un pH neutro (pH 7, aproximadamente) y eluida con una solución amortiguadora de pH bajo (por ejemplo, solución amortiguadora de citrato con un pH de 3,5). Los anticuerpos eluidos se neutralizan con una solución que tiene una alta capacidad de solución amortiguadora
, como pH 9 con Tris de 1 M, o por medio de la desalación.
Un problema con el uso de la cromatografía de afinidad de la proteína A es que los anticuerpos, al igual que otras proteínas, pueden ser inestables al pH bajo requerido para la elusión. Si la proteína es inestable a un pH bajo, puede precipitarse durante o después de la elusión.
Generalmente, la precipitación depende de la concentración de la proteína: una alta concentración favorece la acumulación y la precipitación. De esta manera, a pesar de que la mayoría de los medios de cromatografía pueden vincular al menos 20 g de anticuerpos por litro de medios, la estabilidad de la proteína a un pH bajo, después de la elusión, se convierte en el factor limitante para la carga del medio. A pesar de que muchos anticuerpos son sensibles al pH, el mecanismo de desnaturalización
y acumulación varía según la estructura y requerirá diferentes soluciones de amortiguación para obtener una estabilidad óptima.
Para mejorar la capacidad de carga y la economía del proceso de cromatografía de la proteína, la proteína necesita ser estabilizada en la solución amortiguadora de elusión. La DSC se puede utilizar para definir la estabilidad del anticuerpo como una función del pH y determinar qué aditivos pueden mejorar la estabilidad de la proteína a un pH bajo. En la DSC, un aumento en la temperatura de transición (Tm) sugiere un aumento de la estabilidad de la proteína. El paso de cromatografía de la proteína A se puede volver más viable económicamente mediante la estabilización del anticuerpo en la solución amortiguadora de elusión de pH bajo, lo que produce un aumento de la capacidad de carga.
En un estudio de caso, un cliente deseaba mejorar el proceso de purificación de su anticuerpo (Anticuerpo X). La información del proceso indicó que la capacidad de vinculación inicial se limitó a 2 g del anticuerpo X por litro del medio de la proteína A, debido a la precipitación de su anticuerpo durante la elusión a una carga mayor. Para comprender el efecto del pH en la estabilidad del anticuerpo X, se preparó la proteína en cuatro soluciones amortiguadoras diferentes: solución amortiguadora de citrato ajustada con Tris a un pH de 7,0; solución amortiguadora de fosfato a un pH de 7,3; solución amortiguadora de citrato a un pH de 3,5 y solución amortiguadora de citrato a un pH de 5,0. A partir de los datos de la DSC (Tabla 1), el anticuerpo X a un pH de 7,0 y 7,3 mostró una Tm más alta que el anticuerpo a un pH de 3,5, lo que indica que la proteína era más estable a un mayor pH. Las temperaturas iniciales de despliegue también fueron altas para un pH de 7,0 y 7,3 en comparación con el pH 3,5. El anticuerpo X con un pH 5,0 tuvo una Tm comparable al pH 7,0 y la temperatura de despliegue inicial fue menor, lo que sugiere que el pH tiene una mayor influencia en la determinación del despliegue de este anticuerpo.
| Tm de transición importante | Comienzo del desenvolvimiento (°C) | |
|---|---|---|
| Solución amortiguadora de citrato de Tris, ph 7,0 | 68,7 | 60,1 |
| PBS, pH 7,3 | 69,5 | 58,5 |
| Citrato, pH 5,0 | 71,5 | 48,2 |
| Citrato, pH 3,5 | 59,3 | 34,1 |
| Citrato + manitol, pH 3,5 | 64,7 | 41,0 |
También se preparó el anticuerpo X en soluciones amortiguadoras de pH bajo con diversos aditivos para determinar si alguno de ellos podía estabilizar el anticuerpo a un pH bajo. Se realizaron experimentos con DSC para determinar qué condiciones podían aumentar la Tm del anticuerpo (Figura 2).
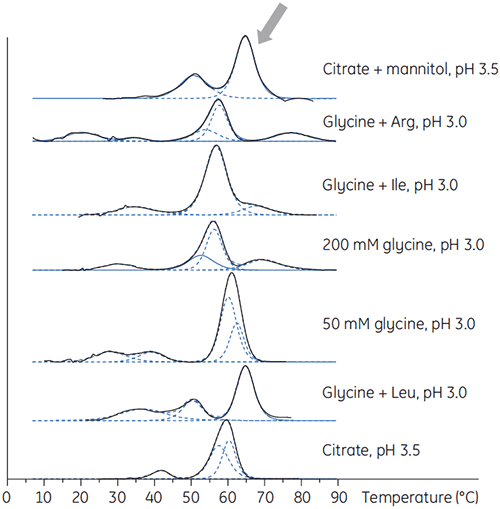
|
Para el anticuerpo X, el pH de 3,5 de citrato con manitol fue el mayor cambio de Tm, lo que indica la estabilidad más favorable. La adición de manitol aumentó tanto la Tm y la temperatura inicial de despliegue relativa al citrato a un pH de 3,5. (Figura 3).
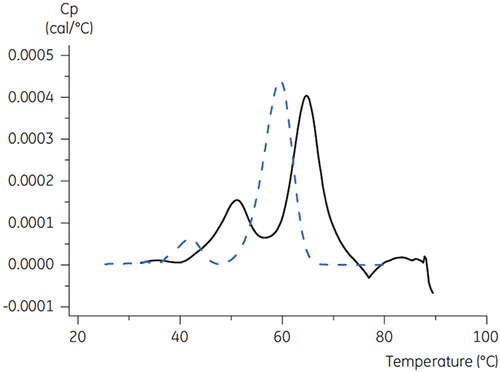
|
Los resultados de la DSC sugieren que la adición de manitol a la solución amortiguadora de elusión para el medio de afinidad de la proteína A mejoraría la estabilidad del anticuerpo X. La estabilidad mejorada del anticuerpo durante la elusión puede aumentar la carga del anticuerpo al medio de cromatografía de la proteína A.
Los esfuerzos de desarrollo del proceso por medio de la información de estabilidad de la proteína, determinados a partir de la DSC, tuvieron como resultado un aumento de la carga del anticuerpo X durante el paso de captura de la proteína A. El uso de citrato con manitol como solución amortiguadora de elusión de la proteína A tuvo como resultado un aumento de al menos 7,5 de la capacidad a ≥15 g de anticuerpo X por cada litro del medio de la proteína A, en comparación con los 2 g por litro con solución amortiguadora solo de citrato.
Luego del paso de captura de la proteína A, el anticuerpo X estaba más concentrado que al comienzo del proceso, lo que elimina el paso de ultrafiltración/diafiltración, lo que a su vez produce un ahorro en los materiales y el tiempo de procesamiento.
En esta nota de aplicación, los datos de DSC se utilizaron para identificar las condiciones de elusión más estabilizadoras para el paso de captura del anticuerpo durante el desarrollo del proceso de una proteína. La DSC proporciona información valiosa para la elección de las condiciones de la solución amortiguadora para la estabilización de la proteína antes de que se realice el desarrollo cromatográfico. La capacidad de mejorar el rendimiento en este paso fundamental en el desarrollo de procesos de purificación puede tener como resultado ahorros financieros transformadores importantes.
Esta nota de aplicación fue creada por Prathima Acharya, en colaboración con Diosynth Biotechnology. Se agradece la colaboración de Rochelle Bazemore, Sorina Morar, Sue Cook y Jessica Weaver del Purification Development Group para la realización de este trabajo.