¿Qué es el potencial Zeta? -1: Introducción a la medición del potencial Zeta
Introducción
El potencial Zeta es una propiedad física que representa todas las partículas dentro de una suspensión. Además, puede mostrar claramente el comportamiento de las suspensiones y emulsiones. Comprender el potencial Zeta reduce el tiempo necesario para crear formulaciones de prueba. También permite predecir la estabilidad a largo plazo.
Ciencia de los Coloides
Las tres formas fundamentales de la materia son sólido, líquido y gas. Si una de estas formas se dispersa finamente en otra forma, se denomina sistema coloidal. Estas sustancias presentan propiedades especiales de importancia práctica significativa.
Un sistema coloidal incluye varios ejemplos como aerosoles, emulsiones, suspensiones coloidales y coloides asociados. En ciertas condiciones, las partículas en la dispersión se combinan para formar agregados, aumentando de tamaño y sometiéndose a la influencia de la gravedad.
Al principio, los agregados formados se llaman flóculos y su proceso de formación se llama floculación. Los flóculos pueden o no sedimentar o separarse en fases.
Los agregados más densos con el tiempo son llamados grumos.
La unión entre partículas ocurre al sedimentarse si su densidad es mayor que la del medio, y crean una crema si es menor, resultando en separación. Estos procesos de floculación y coagulación son a menudo intercambiables.
A diferencia de la floculación, que es generalmente reversible, los reacciones de coagulación tienden a ser irreversibles, provocando defloculación.
La Figura 1 ilustra estos procesos.

Estabilidad coloidal y teoría DVLO
En 1940, los científicos Derjaguin, Verwey, Landau y Overbeek desarrollaron una teoría relacionada con la estabilidad dentro de un sistema coloidal. La teoría DVLO propone que la estabilidad de las partículas en una solución depende de la función de energía total de las partículas. ![]() .
.
![]() se determina por algunas contribuciones que se detallan a continuación.
se determina por algunas contribuciones que se detallan a continuación.
![]()
![]() es la energía potencial atribuida al solvente, y es uno de los términos menos significativos al interactuar en la separación de cierto número de nanopartículas. Los factores más significativos son el balance de
es la energía potencial atribuida al solvente, y es uno de los términos menos significativos al interactuar en la separación de cierto número de nanopartículas. Los factores más significativos son el balance de ![]() y
y ![]() , que presentan distribuciones de fuerzas atractivas y repulsivas. El más fuerte potencialmente en grandes distancias es
, que presentan distribuciones de fuerzas atractivas y repulsivas. El más fuerte potencialmente en grandes distancias es ![]() .
.
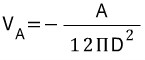
Está representado por A que es la constante de Hamaker y D que expresa la separación de partículas.
El potencial que representa la repulsión, ![]() , tiene una ecuación más compleja.
, tiene una ecuación más compleja.
![]()
a es el radio de la partícula, π es la solubilidad del solvente, κ es la composición iónica, y ζ es función del potencial Zeta.

La teoría DVLO postula que la estabilidad en sistemas coloidales se decide por la suma de las fuerzas atractivas de Van der Waals y las fuerzas repulsivas del doblete eléctrico que existen entre las partículas durante su movimiento browniano. Esta teoría refleja la barrera energética causada por la repulsión que impide que las partículas se fusionen.
Si las partículas no superan esta barrera energética, la atracción causará que se unan de manera irreversible. Por lo tanto, con alta repulsión, la dispersión se mantiene sin floculación, y el sistema coloidal se estabiliza.
Sin embargo, sin un mecanismo repulsivo, la coagulación o sedimentación inevitablemente ocurrirán.

Cuando el potencial Zeta baja (en alta concentración de sal), es posible que ocurra un ‘segundo mínimo’ si hay una unión débil y potencialmente reversible entre partículas. (Figura 2 (b))
Este flóculo débil es estable bajo el movimiento browniano pero se dispersará si sufre fuerzas externas, como la agitación forzada.
Por lo tanto, para mantener la estabilidad de un sistema coloidal, la repulsión debe ser dominante. ¿Cómo se logra la estabilidad de un sistema coloidal?
Hay dos mecanismos fundamentales que afectan la estabilidad de una dispersión.
Repulsión estérica: Esto implica polímeros adsorbidos en la superficie de partículas para evitar que las superficies de partículas se acerquen. Si la adsorción es suficiente, las fuerzas de repulsión estéricas entre las capas por el recubrimiento son suficientes para mantener la separación de partículas, haciendo que la fuerza de Van der Waals sea demasiado débil para unir las partículas.

Estabilidad electrostática o por carga: Este es un efecto de interacción de partículas debido a la distribución de carga dentro del sistema. Cada mecanismo tiene sus ventajas en la aplicación de ciertos sistemas. La estabilidad estérica es simple y requiere solo polímeros adecuados.
Sin embargo, los polímeros pueden ser costosos y, por ejemplo, en el caso de resbalones de cerámica, los polímeros pueden quemarse durante el moldeado y sinterizado, lo que no es adecuado. Además, pueden causar contracción como una desventaja. La estabilidad electrostática o por carga es beneficiosa en la estabilización de sistemas floculados o la modificación de la densidad de iones dentro de un sencillo sistema incluso.
Este es un proceso reversible y no es caro. El potencial Zeta ha sido reconocido durante mucho tiempo como un buen indicador para medir el grado de interacción entre partículas en sistemas coloidales, y la medición del potencial Zeta general se usa para verificar la estabilidad de un sistema coloidal.
Carga superficial
La mayoría de las dispersiones coloidales en medios acuosos portan carga. Hay muchas causas para la carga superficial que dependen de la naturaleza básica de la partícula y el ambiente que la rodea, pero consideraremos los mecanismos más significativos.
Ionización de grupos superficiales
La disociación de grupos ácidos en la superficie de las partículas da lugar a una carga negativa en la superficie, mientras que el proceso contrario, la disociación de grupos básicos, da lugar a cationes en la superficie de las partículas.
Este artículo puede haber sido traducido automáticamente.
{{ product.product_name }}
{{ product.product_strapline }}
{{ product.product_lede }}
