Dans cette note d'application, le MicroCal VP-Capillary DSC de Malvern a été utilisé pour un criblage rapide de tampons pour le développement d'une préformulation et l'optimisation des conditions de stockage des anticorps durant un processus de développement. Les résultats correspondent bien à ceux obtenus par d'autres techniques beaucoup plus gourmandes en temps de travail.
L'utilisation de substances biothérapeutiques, telles que des anticorps et autres molécules de type protéine, pour le traitement des maladies, est en croissance rapide dans l'industrie pharmaceutique. Les substances biothérapeutiques doivent souvent être utilisées à des concentrations élevées et en plusieurs doses, le fabricant doit donc produire la protéine médicamenteuse dans des quantités de l'ordre du kilogramme, au minimum. Le processus de fabrication des substances biothérapeutiques implique l'expression d'une protéine dans des milliers de litres de milieu dans des bioréacteurs, avant de les faire passer dans un procédé de purification utilisant des colonnes chromatographiques de grande dimension et des systèmes de filtration.
La stabilité de la protéine dans les conditions du procédé, la réversibilité des changements de conformation et toute éventuelle propension à s'agréger dépendent de facteurs tels que le pH et la composition du tampon. Une compréhension profonde de ces facteurs est importante pour la sélection des conditions du procédé, la formulation et le développement des méthodes d'analyse. Les étapes du processus de purification d'un anticorps susceptibles de provoquer une instabilité de la protéine sont l'étape d'élution à pH bas dans une colonne contenant une protéine A, l'étape de rétention à pH bas destinée à l'inactivation virale et toute étape impliquant un ajustement du pH et/ou de la force ionique, y compris dans la formulation finale.
La calorimétrie différentielle à balayage (DSC) fournit des informations sur la stabilité thermique d'une protéine dans des conditions de pH et de cosolutés différentes, à travers l'identification des points médians des transitions thermiques, Tm. Plus élevée est la Tm meilleure est la stabilité thermique, laquelle est en corrélation avec la stabilité à long terme. Cette note d'application décrit comment Diosynth Biotechnology utilise des données de stabilité thermique obtenues par DSC pour caractériser la stabilité d'un anticorps lors du criblage initial du pH et du tampon pour le développement d'une préformulation et l'optimisation de l'inactivation virale à pH bas utilisée dans le processus de fabrication. L'inactivation à pH bas est souhaitable pour la fabrication des protéines, sous réserve qu'elle n'induise pas une diminution de la stabilité des protéines.
La DSC a été réalisée sur un système MicroCal VP-Capillary DSC de Malvern. Lors des études de développement de préformulation, une palette de tampons de pH allant de 3 à 8 a été utilisée. La protéine (anticorps X) a été stockée dans chaque tampon, et des dosages ont été réalisés immédiatement (t = 0) et après une semaine de stockage (t = 1 semaine).
Pour l'optimisation des conditions de purification, les thermogrammes de DSC de l'anticorps Y (dans un tampon Tris neutre contenant du NaCl et de l'EDTA, pH 7,4) ont été étudiés et comparés à ceux d'un tampon citrate de pH 3 et au tampon citrate ajusté à pH 6 avec 2 M de Tris, pH 9,0.
Les thermogrammes du tampon seul ont été soustraits de chaque protéine avant l'analyse à l'aide du logiciel Origin™ 7.0, doté du logiciel d'analyse MicroCal VP-Capillary DSC.
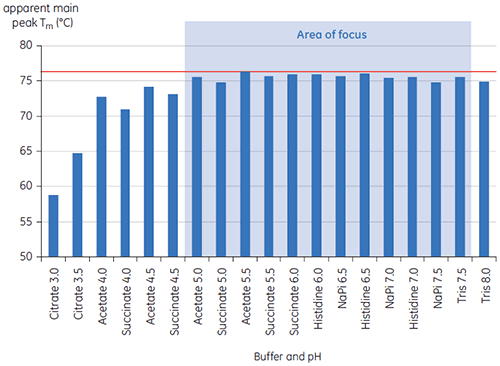
Les valeurs du pic de Tm principal à t = 0 pour l'anticorps X dans l'étude initiale des 19 tampons pour le développement de la préformulation, sont représentées sur la figure 1. Les thermogrammes de l'anticorps dans deux de ces tampons sont représentés sur la figure 2. À partir des valeurs de Tm, on observe que les conditions de tampon les plus stables se situent entre pH 5,0 et pH 7,5. À t = 0, d'autres méthodes analytiques (UV, chromatographie d'exclusion stérique (SEC), diffusion de la lumière, et SDS-PAGE) ont montré une bien moindre discrimination entre les différentes conditions tampon par rapport à la DSC (données non représentées).
|
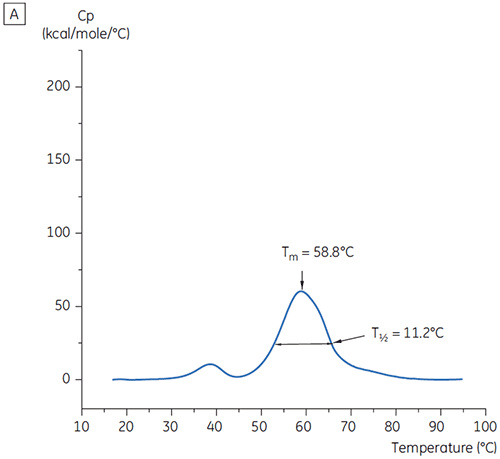
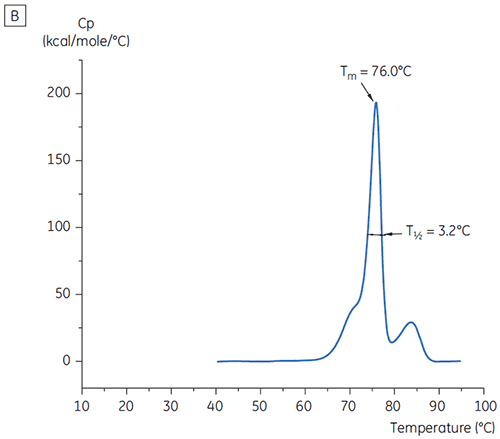
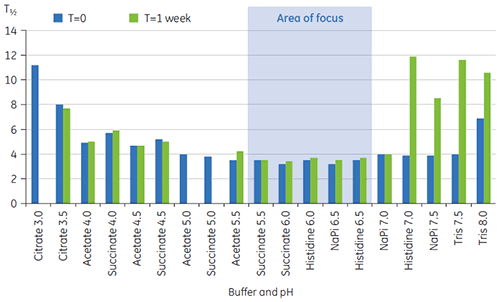
Les valeurs de T½ ont été utilisées pour une meilleure discrimination entre les conditions, comme cela est indiqué sur la figure 2. T½ est la largeur du pic à mi-hauteur pour la transition principale du thermogramme de DSC et reflète généralement la coopération de la transition thermique. Une valeur de T½ basse peut indiquer une structure compacte et est par conséquent préférable pour les formulations. Dans le cas présent, les valeurs de T½ les plus basses ont été trouvées pour les tampons dont le pH était compris entre 5,5 et 6,5 (figure 3).
|
|
|
Un tampon citrate de pH 3 est un candidat à la fois pour l'élution de l'anticorps de la colonne d'affinité avec la protéine A et pour l'étape subséquente de rétention à pH bas pour l'inactivation virale. Comme la plupart des protéines tendent à devenir instables lors de l'exposition prolongée à des pH aussi bas, le pH doit être augmenté immédiatement après l'étape d'inactivation virale.
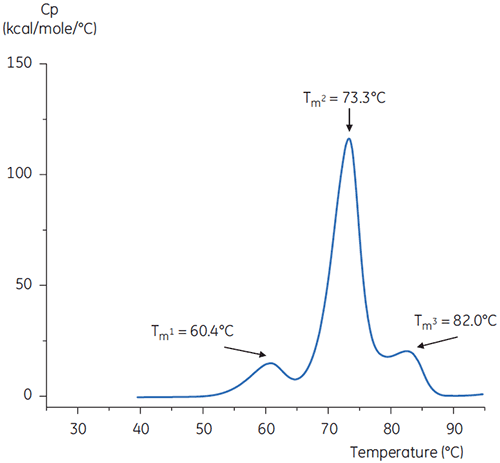
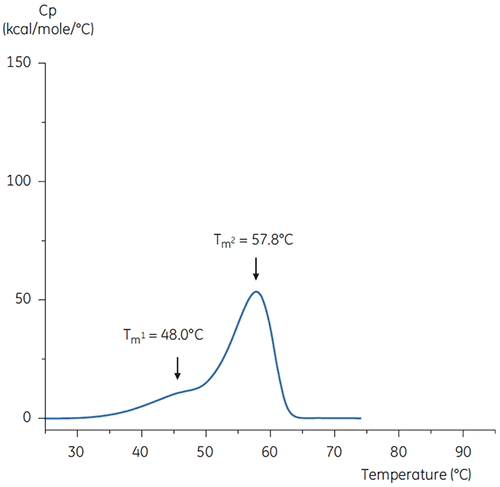
Les thermogrammes DSC de l'anticorps dans le tampon de pH neutre et de pH 3 sont représentés sur les figures 4 et 5.
|
|
Les différences de forme et de motif des deux thermogrammes démontrent la perte de stabilité thermique de l'anticorps dans le tampon de pH 3,0. La hauteur du pic de la transition à Tm2 est inférieure, le pic est plus large et la définition entre la première et la seconde transition à pH 3,0 est moins bonne que celle obtenue à pH 7,4.
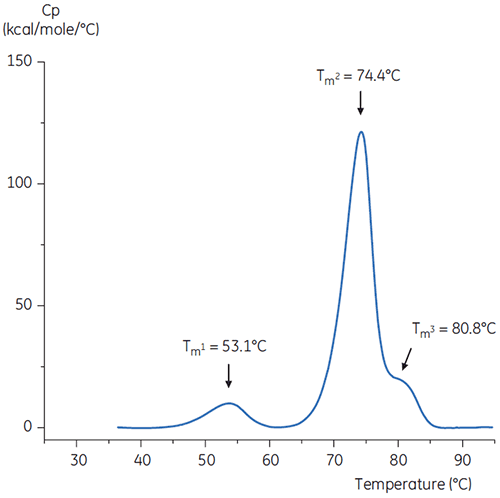
Pour imiter l'étape de neutralisation, le pH de la solution d'anticorps a été ajusté à pH 6,0 avec une solution de Tris concentrée de pH 9. Le thermogramme de la solution d'anticorps résultante est représenté sur la figure 6. On constate ici une augmentation de la stabilité thermique par rapport à l'anticorps dans le tampon de pH 3,0. La Tm2 et la Tm3 de l'anticorps dans la solution de pH 6,0 sont similaires à la Tm2 et la Tm3 de l'anticorps dans le tampon de référence. La forme globale, la définition et la largeur des pics pour les anticorps à pH 6 sont également similaires à celle dans la situation de référence à pH 7,4.
La neutralisation peut également être réalisée en présence d'excipients de stabilisation, comme l'histidine. Dans ce cas, le thermogramme de l'anticorps neutralisé en présence d'histidine était pratiquement identique à celui de la figure 6, ce qui indique que pour cet anticorps particulier, l'histidine n'apporte aucun effet stabilisateur significatif.
|
Cette étude montre que la DSC peut être utilisée pour optimiser rapidement le pH et les conditions tampon lors du développement d'une préformulation. Ces données ont été utilisées pour classer les tampons et les intervalles de pH appropriés en vue du criblage subséquent des excipients, ce qui a réduit considérablement le nombre de conditions exploratoires.
La DSC peut également être utilisée pour contrôler la stabilité d'un anticorps lors de l'étape de rétention pour inactivation à pH bas et l'ajustement du pH de 3,0 à 6,0 qui vient ensuite. Ce type d'information sur la stabilité est utile pour la conception et l'optimisation des processus de fabrication biopharmaceutiques.
Ces données ont été aimablement fournies par le Dr Kathrine E. Bowers, FUJIFILM Diosynth Biotechnologies USA Inc.