Dieses Dokument veranschaulicht die Anwendung des Verfahrens zur Untersuchung der Stabilität einzelner Domänen in Multidomänenproteinen und zur Unterstützung der Prozessentwicklung für Antikörper und andere Proteine.
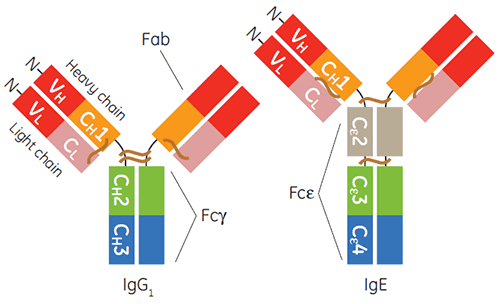
Die Produktion und Aufreinigung von Immunglobulinen des Gamma-Isotyps, insbesondere von humanem IgG1, für diagnostische oder therapeutische Anwendungen ist heute praktisch Routine. Im zurückliegenden Jahrzehnt haben auch IgE-basierte Therapeutika an Bedeutung gewonnen (1 bis 3). IgE ist wichtig für die Wirtsimmunabwehr gegenüber Parasiten und für protektive Entzündungen. Die IgE-vermittelten Signalwege durch die zugehörigen Rezeptoren spielen jedoch auch bei entzündlichen allergischen Erkrankungen eine zentrale Rolle (4). Die konstante Region von IgE ist ein Homodimer, der Doppelpaare von drei einzelnen gefalteten Ig-Domänen enthält (Cε2, Cε3 und Cε4). Dieser ist für die Bindung seiner beiden Rezeptoren FcεRI und CD23, die auch als FcεRII bezeichnet werden (Abbildung 1).
Diese Application Note befasst sich mit der dynamischen Differenzkalorimetrie (DSC) als Instrument zur Aufklärung der vielfachen Aspekte der biotherapeutischen Entwicklungsprozesse von IgG und IgE. Die DSC ermöglicht die rasche Untersuchung der Proteinentfaltung ohne Markierung oder künstliche Sonden. Das Verfahren bestimmt die von einer Probe bei der Entfaltung des Proteins aufgenommene Wärme, die ein Maß für dessen Thermostabilität und ein Kennzeichen für dessen Langzeitstabilität darstellt.
Im Besonderen wird in der hier beschriebenen Arbeit gezeigt, dass die DSC Erkenntnisse über Handhabung, Reinigung und Formulierung von IgG- und IgE-Arzneimitteln liefert. Die Fähigkeit der CD-Spektroskopie (CD), zu diesen Erkenntnissen beizutragen, wird den Möglichkeiten der DSC gegenübergestellt. Die DSC ermöglicht die Untersuchung der Proteinstabilität auf der Ebene einzelner Domänen in Multidomänenproteinen. Dieser Aspekt ist bei den mittels CD gewonnenen Daten weniger transparent.
|
Die Experimente wurden unter Verwendung des MicroCal VP-Capillary DSC von Malvern durchgeführt.
Wie bereits zuvor beschrieben, wurden gereinigte Fcε-, Fcγ- und Fcγ-Cε2-Proteine generiert (5). Die gesamte Serie von DSC-Experimenten - mehr als 400 Durchläufe bei unterschiedlichen pH-Werten - wurde innerhalb eines Zeitraums von vier Monaten mit sehr wenig Aufwand durchgeführt. Es war eine Arbeitszeit von ca. 3 Stunden erforderlich, um die Experimente für Fcε und Fcγ aufzubauen, einschließlich der Messung der Proteinkonzentrationen, der Zubereitung der Verdünnungen und der Einrichtung der Trennstufe. Der verbleibende Teil des Experiments wurde automatisiert durch das MicroCal VP-Capillary DSC ausgeführt. Ausführliche Details werden in (5) beschrieben.
Eine breite pH- und Salzstabilität ist Voraussetzung für viele Prozesse zur Reinigung unterschiedlich affiner Proteine im industriellen Umfeld. Eine geringe Toleranz gegenüber ungewöhnlichen pH- oder Salzbedingungen kann ein aggregiertes oder nicht funktionales Protein zur Folge haben. Die Toleranz von Fcε gegenüber unterschiedlichen pH- oder Salzbedingungen ist eine wichtige Information, um ein geeignetes und skalierbares Reinigungsverfahren für IgE/Fcε-enthaltende Proteine zu finden. Zur Untersuchung der Auswirkung des pH-Werts auf die Sekundärstruktur von Fcε wurden CD-Spektren des Proteins unter Pufferbedingungen zwischen pH 4,5 und pH 7,4 aufgezeichnet.
Zwischen pH 5,2 und pH 7,4 waren die Spektren von Fcε identisch und wiesen ein einzelnes Minimum zwischen 216 und 217 nm auf. Dies weist auf signifikante ß-Faltblattbildung und typische Ig-Domänen hin. Bei pH 5 verschob sich das Fcε-Spektrum zu dem einer Random-Coil-Struktur (das Minimum verschob sich zu 200 nm), und bei pH 4,5 legte das Spektrum die Vermutung nahe, dass das Protein überwiegend als Random Coil vorliegt (5). Basierend auf der pH-abhängigen Entfaltung untersuchten wir, ob Fcε zwischen pH 7,0 und pH 4,5 u. U. eine abgeschwächte Stabilität aufweist.
Eine thermische Denaturierung von Fcε bei unterschiedlichen pH-Werten wurde mittels CD-Spektroskopie im fernen UV-Bereich beobachtet. Bei pH 7,0 lag ein Übergang für die Entfaltung aller drei Domänen vor (Cε2 bis 4). Ein ähnlicher Übergang wurde bei pH 6,0 beobachtet, wenngleich der apparente Tm-Wert um 1 K abnahm. Die thermische Entfaltung von Fcε bei pH 5,2 führte zu einem viel breiteren Übergang, der um 6 K niedriger begann als bei neutralem pH-Wert. Nur bei pH 4,8 waren zwei Übergänge deutlich erkennbar (5).
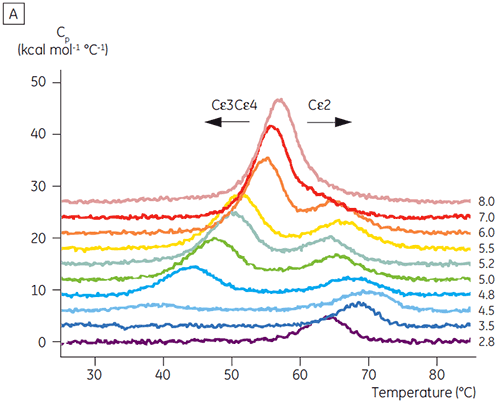
Basierend auf den anfänglichen CD-Ergebnissen wurde mit detaillierten Untersuchungen zur pH-abhängigen Stabilität von Fcε und Fcγ mittels DSC begonnen. Es wurde festgestellt, dass die Entfaltungsübergänge von Fcε und Fcγ irreversibel und abhängig von der Durchlaufrate sind (Daten nicht gezeigt). Dies legt nahe, dass die apparenten Tm-Werte beider Proteine durch eine irreversible Aggregation beeinflusst werden (6, 7). Im Gegensatz zu den Ergebnissen der CD wurde gezeigt, dass Fcε bei allen pH-Werten unter 8,0 zwei unabhängige Entfaltungsübergänge aufweist (Abbildung 2A). Einer dieser Übergänge wurde bei niedrigem pH-Wert und hoher NaCl-Konzentration destabilisiert, der andere hingegen nicht.
|
|
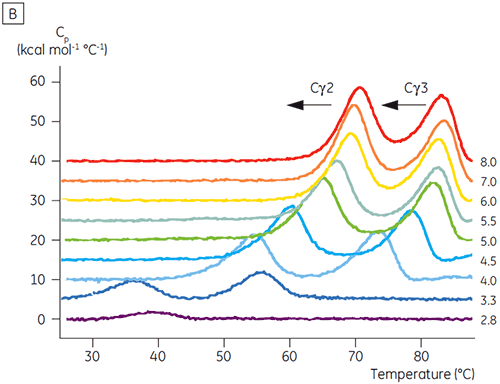
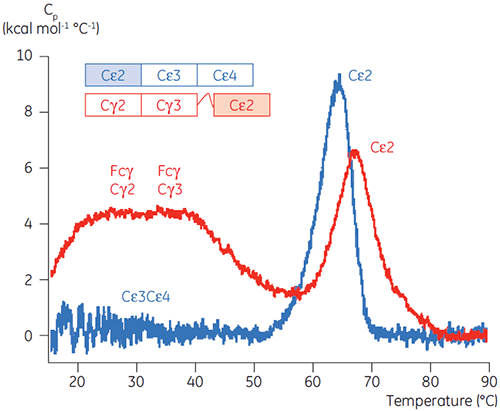
Die am pH-sensitiven Übergang beteiligten Domänen waren bei pH 4,5 vollständig entfaltet. Dies war auch anhand der mittels CD gewonnenen Strukturdaten zu erwarten. Bestätigt wird damit die Bedeutung der DSC für das Verständnis der Stabilität und auch des Faltungsstatus gefalteter Domänen. Es zeigte sich, dass die Entfaltung von Fcγ (von IgG1) über zwei separate Übergänge erfolgte. Dabei entsprechen der Übergang bei niedriger Temperatur der Cγ2-Domäne und der Übergang bei hoher Temperatur der Cγ3-Domäne (Abbildung 2B). Der Cγ2-Übergang wurde anhand der Auswirkung der Deglykosylierung auf seine Thermostabilität erkannt (unveröffentlichte Ergebnisse), der Cγ3-Übergang anhand seiner ungewöhnlich hohen Thermostabilität (8). Es zeigte sich, dass beide Fcγ-Domänen pH- und NaCl-sensitiv waren. Im Gegensatz zu Fcε lagen die Fcγ-Domänen erst dann intrinsisch ungefaltet vor, wenn der pH-Wert auf unter 3,0 gesenkt wurde. Dies erklärt, warum Antikörper von Protein-A-Medien bei pH-Werten unter 3,5 eluieren und warum die Kationenaustauschchromatographie ein geeignetes Aufreinigungsverfahren für IgG sein könnte (Abbildung 3).
|
|
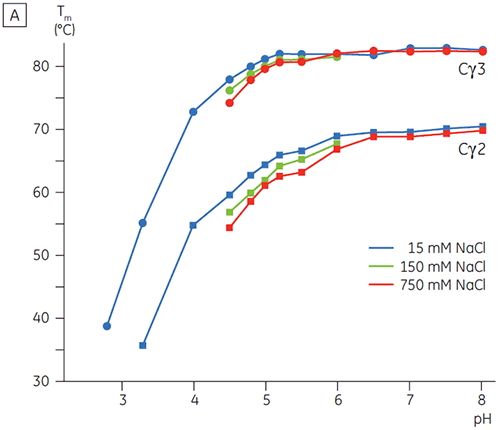
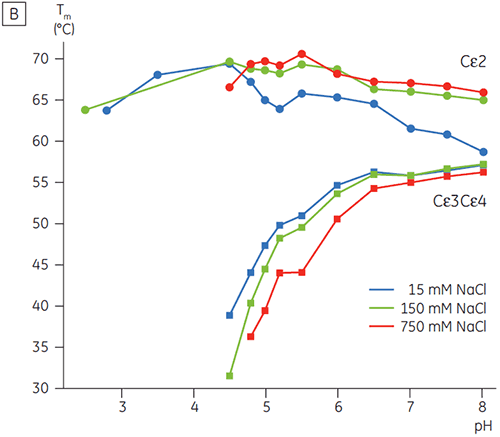
In Gegenwart hoher Salzkonzentrationen waren die Cγ2- und Cγ3-Domänen von Fcγ und die Cε3- und Cε4-Domänen von Fcε destabilisiert. Dies zeigte sich anhand einer geringfügigen Verschiebung der Tm-Werte bei 150 und 750 mM NaCl relativ zu 15 mM NaCl im mittleren pH-Bereich zwischen 5,0 und 7,0 (Abbildung 3A). Diese kleinen Stabilitätsunterschiede dürften keine große Auswirkung auf die In-vitro-Halbwertzeit von Fcγ innerhalb dieses pH-Bereichs haben, da der Tm-Wert der Cγ2- und Cγ3-Domänen oberhalb von 60 °C blieb.
Die pH-sensitiven Domänen von Fcε wurden als die rezeptorbindenden Domänen (Cε3 und Cε4) identifiziert, indem DSC-Experimente mit einem Fcγ-Cε2-Fusionsprotein durchgeführt wurden. Eine Domäne von Fcγ-Ce2 bzw. Fcε bleibt bei pH 2,5 stabil gefaltet (Abbildung 4). Aus den oben beschriebenen Experimenten ist bekannt, dass die Fcγ-Domänen unterhalb von pH 3,0 intrinsisch ungefaltet sind. Standardmäßig wird dadurch die Cε2-Domäne von Fcε als die pH-insensitive Domäne identifiziert. Diese Ergebnisse wurden mittels limitierter Proteolyse von Fcε bei pH 4,5 bestätigt (5).
|
Bei hohen Salzkonzentrationen war die Cε2-Domäne von Fcε geringfügig thermostabiler. Cε2 wurde bei neutralem pH-Wert und 750 mM NaCl speziell stabilisiert. Dabei lag der Tm-Wert um 7 K höher als der bei 15 mM NaCl gemessene Tm-Wert (Abbildung 3B). Im Gegensatz dazu wurden die Cε3Cε4-Domänen durch NaCl zwischen pH 5 und pH 6 signifikant destabilisiert (Abbildung 3B). Bei niedrigen Salzkonzentrationen begann die Entfaltung von Cε3Cε4 bei pH 5,0. Bei hohen Salzkonzentrationen verschob sich der Entfaltungsübergang um 0,5 pH-Einheiten auf pH 5,5. Dies schließt die Anwendung der Kationenaustauschchromatographie als brauchbaren Reinigungsschritt für IgE oder Fcε enthaltende Proteine aus.
In dieser Untersuchung haben wir gezeigt, dass Fcε eine ungewöhnliche pH-Sensitivität aufwies. Diese bewirkte, dass die Entfaltung seiner rezeptorbindenden Domänen bei einem pH-Wert erfolgte, der um 2 pH-Einheiten höher lag, als für Fcγ beobachtet (d. h. bei pH 5,0). Die mittels DSC bestimmte pH- und Salzempfindlichkeit von Fcε liefert zwar wertvolle Informationen zur Auswahl der Reinigungsstrategien, Handhabungsverfahren und Formulierungen für IgE-basierte Proteine. Zudem geht daraus hervor, dass IgG-Standardprotokolle nicht anwendbar sind. Die pH-Stabilitätsdaten für Fcγ weisen zudem auf einen wahrscheinlichen Mechanismus für eine zeitabhängige IgG-Aggregation während üblicher Affinitätsreinigungsverfahren hin (z. B. am typischsten für Protein-A-Medien), die eine Elution bei niedrigen pH-Werten umfasst und u. U. auch Schritte enthält.
Diese Application Note wurde freundlicherweise zur Verfügung gestellt von Dr. Stephen Demarest, Biogen Idec, San Diego, CA.
1. Zhu D. et al. A novel human immunoglobulin Fcγ Fcε bifunctional fusion protein inhibits Fcε RI-mediated degranulation. Nature Med. 8, 518-521 (2002).
2. Zhu D. et al. A chimeric human-cat fusion protein blocks cat-induced allergy. Nature Med. 11, 446-449 (2005).