
Vergleich von Bio-Layer-Interferometrie (BLI), Oberflächenplasmonresonanz (SPR) und Gitter-gekoppelter Interferometrie (GCI)

Das Wissen über die Wechselwirkungen zwischen Molekülen, insbesondere der Kinetik, kann viele Fragen beantworten. Daher ist es nicht überraschend, dass sie in vielen Forschungsbereichen analysiert werden müssen.
Eventuell müssen Sie wissen, wie ein Molekül mit einem Rezeptor interagiert, um zu verstehen, wie die Signalübertragung in einem Organismus funktioniert. Oder möglicherweise möchten Sie verstehen, ob und wie fest sich ein Medikament an eine Substanz bindet, die für die Arzneimittelforschung von Interesse ist. Die Bindungsaffinität kann uns darüber Auskunft geben, aber wir können noch mehr Informationen durch die Messung der Bindungskinetik erhalten.
Die Anwendungen, für die Bindungskinetik relevant ist, sind so zahlreich wie die Technologien, und es können verschiedene Technologien verwendet werden, um sie zu erforschen. Wir vergleichen hier drei davon.
Hinweis: Weitere Informationen zur Messung von Wechselwirkungen, Thermodynamik und mehr finden Sie auf unserer ITC-Technologieseite.
![[label free 2.png] label free 2.png](https://dam.malvernpanalytical.com/f38155b2-4fa2-4ed4-8366-ae6000effacd/label%20free%202_Original%20file.png)
Bio-Layer-Interferometrie (BLI) ist eine optische, oberflächenbasierte, markerfreie Technologie. Im Gegensatz zu anderen Biosensor-Technologien arbeitet die BLI nicht mit einem mikrofluidischen Fluss, sondern durch Eintauchen der Sensorspitzen in die Probe/den Puffer. Das Licht, das von der Spitze einer optischen Faser reflektiert wird, zeigt eine Phasenverschiebung in Abhängigkeit vom Brechungsindex in der Nähe der Oberfläche der Spitze. Das reflektierte Licht interferiert mit Licht, das von einer internen Referenzfläche reflektiert wird.
Unter Verwendung von weißem Licht als Quelle wird ein spektrales Interferenzmuster aufgezeichnet, das Informationen über den Brechungsindex in der Nähe der Spitze umfasst. Wenn sich Biomoleküle an die in die experimentelle Lösung eingetauchte Biolayer-Oberfläche (z. B. eine Probe) binden, ändert sich das Brechungsindexprofil und damit auch das Spektralmuster.
Oberflächenplasmonresonanz (SPR) ist eine weitere optische, markerfreie Analysemethode – tatsächlich war es eine der ersten oberflächenbasierten, markerfreien Technologien. SPR erkennt Änderungen des Brechungsindex, die durch molekulare Wechselwirkungen innerhalb eines abklingenden Feldes in der Nähe einer Sensoroberfläche verursacht werden.
Bei diesen Sensoren wird eine Metallschicht auf einem Glasträger mit Licht einer bestimmten Wellenlänge beleuchtet. In einem bestimmten Winkel werden je nach Brechungsindex nahe der Oberfläche so genannte Oberflächenplasmonen erregt. Da diese Energie im reflektierten Lichtstrahl fehlt, bildet sich bei der Projektion auf den Sensor ein „Absinken“ der Strahlintensität.
Durch die Positionsbestimmung des Absinkens in Echtzeit misst die SPR Änderungen im Brechungsindex auf der Metalloberfläche. Die Lösungen, die den Analyten enthalten, werden mithilfe von Mikrokanälen injiziert, und mindestens eine Referenzflusszelle wird verwendet, um Masseneffekte zu eliminieren.
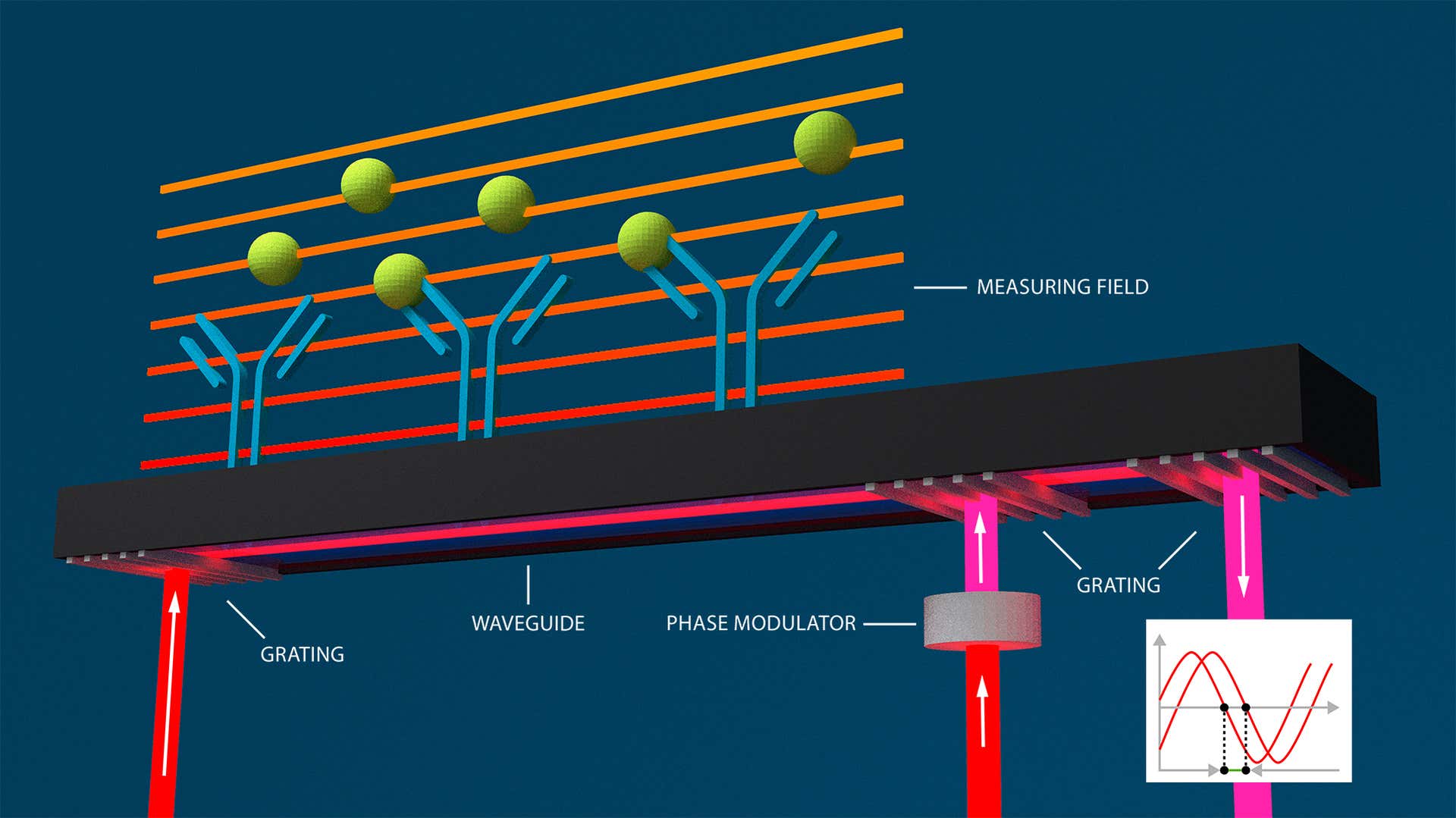
Auf Grundlage der Wellenleiter-Interferometrie, einer weiteren markerfreien Methode, kann die Gitter-gekoppelte Interferometrie (GCI) molekulare Wechselwirkungen in Echtzeit überwachen und charakterisieren. Sie kann dabei kinetische Ratenparameter, Affinitätskonstanten und Konzentrationen von Analytmolekülen bestimmen, die mit einem immobilisierten Liganden interagieren.
Bei der Wellenleiter-Interferometrie werden Änderungen des Brechungsindex innerhalb des abklingenden Feldes eines Wellenleiters in der Nähe einer Sensoroberfläche gemessen. Diese Änderungen bewirken auch eine Änderung der Lichtphase. Das Licht wird durch den Wellenleiter geleitet und erzeugt eine abklingende Welle, die die gesamte Länge der Sensoroberfläche abdeckt. Die Phasenänderungen werden interferometrisch angezeigt. Die GCI-Technologie von Creoptix nutzt die Vorteile der Wellenleiter-Interferometrie und beseitigt die typischen Ausrichtungsprobleme:
![[GCI_CX_weblandscape.jpg] GCI_CX_weblandscape.jpg](https://dam.malvernpanalytical.com/b266ecf3-637f-41d5-a36a-ae29010df43c/GCI_CX_weblandscape_Original%20file.jpg)
Die beste biomolekulare Interaktionstechnik hängt von der Anwendung und den Zielen des Anwenders ab. Im Folgenden erfahren Sie, wie diese drei Techniken im Vergleich anhand von vier Hauptanforderungen abschneiden: breiter Anwendungsbereich, Messung der schwächsten Bindemittel, Messung der festesten Bindemittel und geringer Systemwartungsaufwand.
| Gitter-gekoppelte Interferometrie (GCI) | Oberflächenplasmonresonanz (SPR) | Bio-Layer-Interferometrie (BLI) | |
|---|---|---|---|
| Breitestes Anwendungsspektrum Für eine Vielzahl von Molekülen von niedrigen bis hohen Molekulargewichten, gereinigt oder roh, geeignet. | Ja Geeignet für Fragmente, kleine Moleküle, Peptide, Proteine, Viren, Zellkulturüberstände, Seren, Zelllysate | Nein Geeignet für kleine Moleküle, Peptide (eingeschränkte Eignung für Fragmente, Viren, Zellkulturüberstände, Seren, Zelllysate) | Nein Geeignet für Zellkulturüberstände, Seren, Zelllysate (eingeschränkte Eignung für Peptide, Proteine, Viren) |
| Messung der schwächsten Bindemittel Fähigkeit, Kinetik mit schnellen Off-Raten zu messen, dank schneller Fluidik und hoher Erfassungsraten. | Ja Off-Raten bis zu kd=10 s-1 | Nein Off-Raten bis zu kd=1 s-1 | Nein Off-Raten bis zu kd=0,1 s-1 |
| Messen der festesten Bindemittel Fähigkeit, die Kinetik auch bei festen Bindemitteln und schnellen On-Raten genau zu messen. | Ja Messung unter Strömungsbedingungen | Ja Messung unter Strömungsbedingungen | Nein Messung unter diffusionsbeschränkten Bedingungen (keine Mikrofluidik) |
| Geringer Systemwartungsaufwand Geringe Ausfallzeiten aufgrund von Service oder unerwarteten Reparaturen. | Ja Verstopfungsfreie Mikrofluidik | Nein Herkömmliche Mikrofluidik | Ja Keine Mikrofluidik |
