Comparación entre la interferometría de biocapas (BLI), la resonancia de plasmones superficiales (SPR) y la interferometría acoplada a rejilla (GCI)

Comprender la interacción entre moléculas, sobre todo la cinética, puede responder muchas preguntas, por lo que no es de extrañar que deba analizarse en muchas áreas de investigación.
Por ejemplo, puede que necesite saber cómo interactúa una molécula con un receptor para comprender cómo se produce la señalización en un organismo. O puede que quiera saber si un fármaco se une a un compuesto de interés para el descubrimiento de fármacos y con qué intensidad. La afinidad de unión puede decirnos esto, pero podemos obtener más detalles a través de la medición de la cinética de unión.
Las aplicaciones en las que la cinética de unión es relevante son tan amplias como las tecnologías, y para estudiarlas se pueden utilizar varias tecnologías. Aquí comparamos tres.
Nota: Para obtener más información sobre la medición de interacciones, termodinámica y más, consulte nuestra página sobre tecnología de ITC.
![[label free 2.png] label free 2.png](https://dam.malvernpanalytical.com/f38155b2-4fa2-4ed4-8366-ae6000effacd/label%20free%202_Original%20file.png)
La interferometría de biocapas (BLI, del inglés Biolayer Interferometry) es una tecnología óptica, basada en la superficie y sin etiquetas. A diferencia de otras tecnologías de biosensores, la BLI no funciona con un flujo microfluídico, sino por inmersión de las puntas del sensor en la muestra/amortiguador. La luz reflejada en la punta de una fibra óptica presenta un cambio de fase que depende del índice de refracción cerca de la superficie de la punta. La luz reflejada interfiere en la luz reflejada en una superficie de referencia interna.
A través del uso de luz blanca como fuente, se registra un patrón de interferencia espectral, que comprende información sobre el índice de refracción cerca de la superficie de la punta. A medida que las biomoléculas se unen a la superficie de la biocapa sumergida en la solución experimental (como una muestra), cambia el perfil del índice de refracción y, por tanto, el patrón espectral.
La resonancia de plasmones superficiales (SPR, del inglés Surface Plasmon Resonance) es otro método de análisis óptico libre de etiquetas; de hecho, fue una de las primeras tecnologías sin etiquetas basadas en superficies. La SPR detecta los cambios del índice de refracción causados por las interacciones moleculares dentro de un campo evanescente cerca de la superficie de un sensor.
En estos sensores, una película metálica sobre un soporte de vidrio se ilumina con luz de una longitud de onda específica. En un ángulo determinado, en función del índice de refracción próximo a la superficie, se excitan los denominados plasmones de superficie. Dado que falta esa energía en el haz de luz reflejado, se forma una “inmersión” de intensidad cuando se proyecta sobre el sensor.
Cuando se determina la posición de la inmersión en tiempo real, la SPR mide los cambios del índice de refracción en la superficie metálica. Las soluciones que contienen el analito se inyectan a través de microcanales, y se utiliza al menos una celda de flujo de referencia para eliminar los efectos a granel.
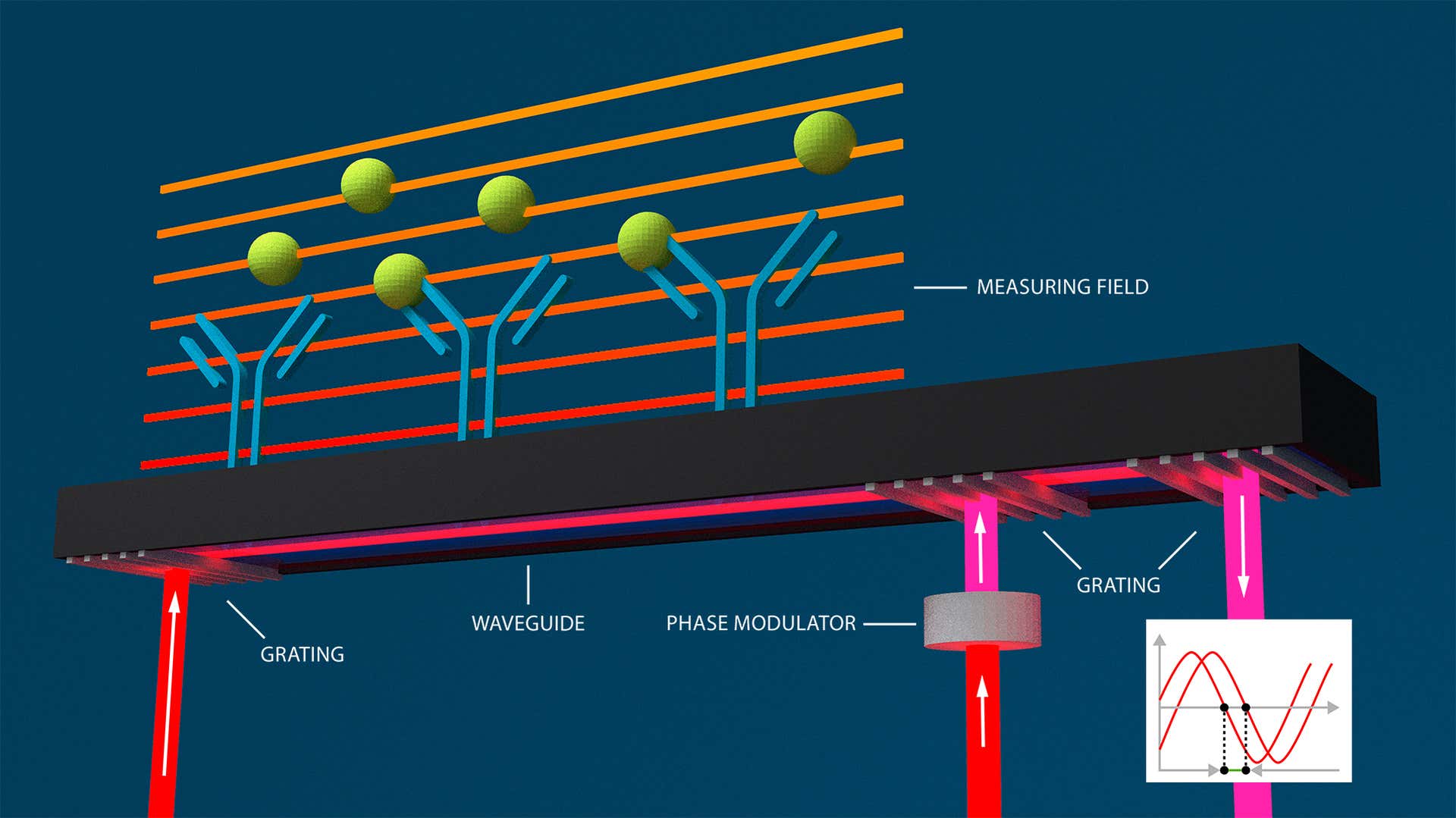
Basada en la interferometría de guía de ondas, otro método óptico sin etiquetas, la interferometría acoplada a rejilla (GCI, del inglés Grating-Coupled Interferometry) puede supervisar y caracterizar interacciones moleculares en tiempo real, y determinar los parámetros de velocidad cinética, las constantes de afinidad y las concentraciones de moléculas de analito que interactúan con un ligando inmovilizado.
En la interferometría de guía de ondas, los cambios en el índice de refracción se miden dentro del campo evanescente de una guía de ondas cerca de la superficie de un sensor. Estos cambios hacen que también cambie la fase de la luz. La luz viaja a través de la guía de ondas, lo que crea una onda evanescente que abarca toda la longitud de la superficie del sensor. Los cambios de fase se visualizan interferométricamente. La tecnología de GCI de Creoptix aprovecha las ventajas de la interferometría de guía de ondas y elimina sus típicos problemas de alineamiento:
![[GCI_CX_weblandscape.jpg] GCI_CX_weblandscape.jpg](https://dam.malvernpanalytical.com/b266ecf3-637f-41d5-a36a-ae29010df43c/GCI_CX_weblandscape_Original%20file.jpg)
La mejor técnica de interacción biomolecular dependerá de la aplicación y de los objetivos del usuario. A continuación, puede ver cómo se comparan estas tres técnicas para cuatro requisitos clave: una gama de aplicación amplia, medición de los aglutinantes más débiles, medición de los aglutinantes más ajustados y bajo mantenimiento del sistema.
| Interferometría acoplada a rejilla (GCI) | Resonancia de plasmones superficiales (SPR) | Interferometría de biocapas (BLI) | |
|---|---|---|---|
| La gama de aplicaciones más amplia Adecuada para diversas moléculas que van desde pesos moleculares bajos a altos, purificadas o crudas. | Sí Adecuado para fragmentos, moléculas pequeñas, péptidos, proteínas, virus, precipitado de cultivos celulares, sueros, lisatos celulares | No Adecuado para moléculas pequeñas, péptidos (idoneidad limitada para fragmentos, virus, precipitado de cultivos celulares, sueros, lisatos celulares) | No Adecuado para precipitado de cultivos celulares, sueros, lisatos celulares (idoneidad limitada para péptidos, proteínas, virus) |
| Medición de los aglutinantes más débiles Capacidad para medir la cinética con constantes de disociación rápidas gracias a los fluídicos rápidos y a las altas velocidades de adquisición. | Sí Constantes de disociación de hasta kd=10 s-1 | No Constantes de disociación de hasta kd=1 s-1 | No Constantes de disociación de hasta kd=0,1 s-1 |
| Medición de los aglutinantes más ajustados Capacidad de medir la cinética con precisión incluso para aglutinantes ajustados y constantes de asociación rápidas. | Sí Medición en condiciones de flujo | Sí Medición en condiciones de flujo | No Medición en condiciones de difusión limitada (sin microfluídicos) |
| Bajo mantenimiento del sistema Poco tiempo de inactividad causado por servicio o reparaciones inesperadas. | Sí Microfluídicos sin obstrucciones | No Microfluídicos tradicionales | Sí Sin microfluídicos |