Les meilleures pratiques pour la calorimétrie de titrage isotherme pour étudier les interactions de liaison – Partie 1
Voici plusieurs meilleures pratiques pour effectuer des expériences de liaison traditionnelles avec les systèmes MicroCal PEAQ-ITC, VP-ITC et ITC200.
Exigences des échantillons :
-
- Par convention, la « macromolécule » est la biomolécule dans la cellule des calorimètres de titrage isotherme (ITC), et le « ligand » est la biomolécule dans la seringue ITC. Il peut s’agir de toute molécule (protéine, acide nucléique, inhibiteur de petite molécule, métal, etc.) qui interagit l’une avec l’autre. Les « titrages inverses » peuvent également être effectués, avec le « ligand » dans la seringue.
- Le « ligand » possède un site de liaison, aux fins de l’analyse des données selon le modèle de liaison à un ensemble de sites, et d’autres modèles d’analyse de données ITC couramment utilisés. La « macromolécule » peut avoir n’importe quel nombre de sites de liaison.
- Tous les échantillons doivent être aussi purs que possible pour l’ITC. Évitez ou éliminez les impuretés chimiques et conformationnelles, car elles peuvent avoir un impact sur la détermination précise de la concentration et éventuellement être impliquées dans ou interférer avec l’interaction de liaison.
- Pour des données ITC de haute qualité, les deux biomolécules doivent être équilibrées dans le tampon désiré, pour éviter les changements de chaleur dus à une discordance de tampon.

- Tampon pour ITC :
- Utilisez un tampon qui maintient la solubilité et la stabilité des biomolécules, et incluez tous les sels, cofacteurs, et additifs nécessaires à la liaison.
- Pour commencer, vous pouvez utiliser le même tampon utilisé pour d’autres études de liaison.
- L’ITC est compatible avec des tampons aqueux entre pH 2 et pH 12. Assurez-vous que la concentration en tampon est suffisante pour maintenir le pH en présence des biomolécules.
- Si le tampon contient du glycérol (ou un autre composant visqueux), maintenez la concentration de glycérol en dessous de 20 % (v/v), pour éviter les bulles dans la cellule ITC et la seringue d’injection.
- Si le tampon contient un tensioactif ou un détergent, maintenez la concentration de tensioactif en dessous de sa concentration micellaire critique (CMC) sauf si vous étudiez les micelles avec l’ITC.
- Si un agent réducteur est nécessaire, nous recommandons l’utilisation de TCEP ou de 2-mercaptoéthanol. Le dithiothreitol n’est pas recommandé.
- Si un ligand nécessite du DMSO pour la solubilité, assurez-vous d’avoir la même concentration finale de DMSO dans les deux partenaires de liaison. La limite supérieure recommandée est de 10 % de DMSO pour les études de liaison ITC.
- Si vous devez utiliser un autre solvant organique, consultez la documentation technique de l’instrument, ou consultez votre équipe de support régional Malvern Panalytical, pour des recommandations et la compatibilité chimique de votre système ITC.
Volumes d’échantillons :
- Voir le Tableau 1. Ce sont les volumes recommandés nécessaires pour remplir la cellule ITC et la seringue en suivant les protocoles recommandés, sans ajout de bulles.

Concentrations d’échantillons :
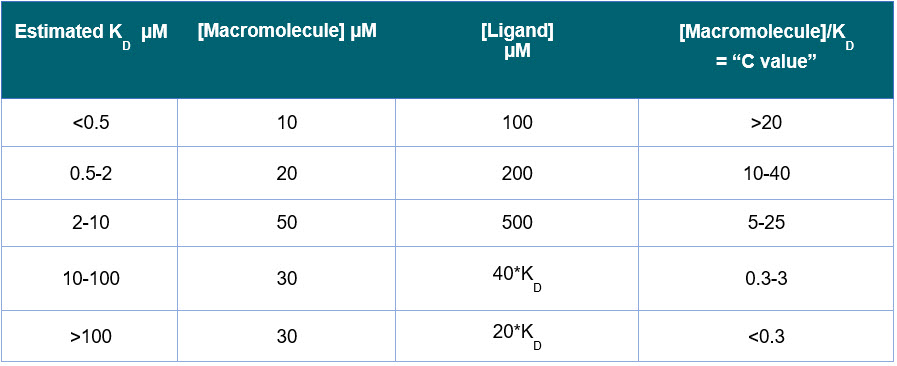
- La concentration initiale de macromolécule dans la cellule ITC est généralement déterminée par le « paramètre C » ou le « facteur de sigmoïdicité », déterminé comme suit :
C= N[M]T/KD - [M]T est la concentration de macromolécule dans la cellule ITC, et N est la stœchiométrie. Pour obtenir une isotherme de liaison ITC raisonnable, la plage optimale est de 5 < C < 500. Dans de nombreux cas, vous pouvez obtenir des données utiles à partir d’une courbe de liaison ITC lorsque C est entre 1 et 1000.
- Pour une liaison 1:1, commencez avec une concentration de ligand 10 fois plus élevée dans la seringue ITC, par rapport à la concentration de macromolécule dans la cellule ITC.
- Si vous avez une estimation du KD, et qu’il y a une liaison 1:1, utilisez le guide du Tableau 2. En supposant qu’il y a un changement de chaleur et une enthalpie de liaison raisonnables, ces plages de concentrations devraient donner une courbe de liaison.
- Si KD est inconnu, essayez un échantillon de 20 μM dans la cellule ITC et un échantillon de 200 μM dans la seringue ITC.
- Concentration minimale dans la cellule ITC : 5-10 μM
- Concentration minimale dans la seringue ITC : 50 μM
Contenu pertinent :
- Calorimétrie de titrage isotherme : Théorie et pratique
- Conseils pratiques pour les expériences MicroCal PEAQ-ITC
- Aborder la complexité des interactions de liaison avec l’ITC – tirer le meilleur parti de vos données ITC
- Biomolécules : qualité des échantillons et des données dans l’analyse des interactions – Deux faces d’une même pièce
- Ne jetez pas vos données ITC aux « mauvaises » valeurs N
- Norme d’or pour l’affinité de liaison
Publications précédentes :
- Meilleures pratiques pour l’ITC pour étudier les interactions de liaison – Partie 2
- Meilleures pratiques pour l’ITC pour étudier les interactions de liaison – Partie 3
- Meilleures pratiques pour l’ITC pour étudier les interactions de liaison – Partie 4
- Calorimétrie de titrage isotherme – Un outil de caractérisation à chaud pour les interactions biomoléculaires
- Club de journal ITC
- Quoi de neuf en ITC ? Édition de juin 2018
{{ product.product_name }}
{{ product.product_strapline }}
{{ product.product_lede }}

