Diese Application Note stellt erster Linie Anwendungen der isothermen Titrationskalorimetrie (ITC) in der Kinaseinhibitor-Forschung vor, geht ansatzweise jedoch auch auf die dynamische Differenzkalorimetrie (DSC) im Wirkstoffforschungsprozess ein.
Das Kinom eines Organismus besteht aus der Summe der Proteinkinasen in seinem Genom. Diese proteinmodifizierenden Enzyme gelten als potenzielle Targets in vielen Therapiegebieten. Untersuchungen zur Charakterisierung des humanen Kinoms haben zusammen mit der starken Zunahme an verfügbaren Kinase-Kristallstrukturen in den letzten Jahren zu einer verstärkten Fokussierung auf Kinasen als potenzielle Targets für pharmazeutische Interventionen geführt.
Das Interesse für Kinasen seitens der pharmazeutischen Industrie entwickelte sich in den späten 1980er Jahren. Die meisten der seit dem entwickelten Kinaseinhibitoren zielen auf die ATP-Bindungsstelle des Enzyms. Die Entwicklung des Arzneimittels Gleevec™, eines Tyrosinkinaseinhibitors, der eine strukturelle Umordnung der Zielkinase BCR-Abl induziert, hat der Forschung auf diesem Gebiet neue Dynamik verliehen. Das Ergebnis waren innovative Ideen zum Verständnis der Kinaseinhibition, z. B. zur Bindung außerhalb der ATP-Bindungsstelle, und zur Verhinderung der Kinaseaktivierung.
Bei der Charakterisierung des Wirkmechanismus von Substanzen, die auf solchen neuartigen Ideen basieren, fällt detaillierten enzymkinetischen Untersuchungen eine entscheidende Rolle zu. Ein äußerst nützliches Verfahren ist die isotherme Titrationskalorimetrie (ITC). Sie liefert ein komplettes thermodynamisches Profil der Bindung einer Substanz an das Zielprotein. Die erhobenen Daten ermöglichen einen Vergleich von Affinitätsmessungen von Substanzen, die an verschiedene Enzymformen binden. Dies können z. B. freie Enzyme, Enzym-Substrat-Komplexe, Enzym-Produkt-Komplexe, aktive und nicht aktive Enzyme sein.
Die Inhibition von Kinase-Signalkaskaden ist ein bewährter therapeutischer Ansatz zur Behandlung von Erkrankungen in den Bereichen Onkologie und Entzündungen. Diese Application Note befasst sich mit der Anwendung der ITC zur Identifizierung des intermolekularen Komplexes von Kinasen, der die biologische Aktivität verleiht. Dabei kann die ITC Informationen darüber liefern, ob die Anwesenheit eines anderen Liganden Einfluss auf diese Aktivität hat.
Mit der isothermen Titrationskalorimetrie kann in einem einzigen Experiment eine Reihe von Eigenschaften einer Bindungswechselwirkung gemessen werden. Hierzu gehören die Affinität (KD), die Anzahl der Ligandenbindungsstellen (n) und die Enthalpie der Bindungsreaktion (∆H). Das Verfahren ist schnell, erfordert keine Fluoreszenzmarker und kann bei Proteinen eingesetzt werden, die keine katalytische Aktivität aufweisen (dies würde ihre Untersuchung in enzymkinetischen Assays ausschließen).
Bei ITC-Experimenten wird in der Regel die Prüfsubstanz bei konstanter Temperatur gegen das Zielprotein titriert. Das ITC-Gerät misst dabei die Wärme, die bei dem Bindungsereignis abgegeben oder aufgenommen wird. In der Wirkstoffforschung mit dem Schwerpunkt Proteinkinasen kann das Verfahren auf vielfältige Weise eingesetzt werden.
Zu diesen gehören:
Charakterisierung von Proteinkonstrukten und -präparaten hinsichtlich der genauen Affinitätsbestimmung von Modellliganden und der exakten Stöchiometriebestimmung. Diese ermöglicht die Abschätzung der Menge an funktionellem Protein, ohne dass eine katalytische Aktivität vorliegen muss.
Bewertung von Assays
Identifizierung des intermolekularen Komplexes, der die biologische Aktivität verleiht. Dabei kann die ITC Informationen darüber liefern, ob die Anwesenheit eines anderen Liganden Einfluss auf die biologische Aktivität einer Prüfsubstanz hat. Damit ist zugleich der Schwerpunkt dieser Application Note bezeichnet.
Vor der Durchführung mechanistischer Untersuchungen ist es hilfreich, wenn nicht gar unerlässlich, das Zielprotein einer Qualitätskontrolle zu unterziehen. Dabei sollten Identität, Reinheit, Konzentration, Funktionalität und Stabilität des Proteins validiert werden.
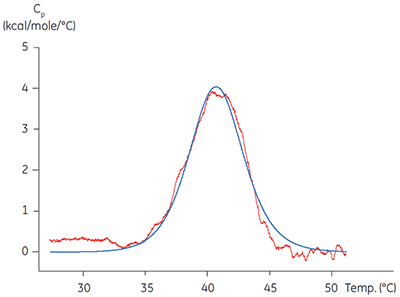
In diesen beiden wichtigen Bereichen können kalorimetrische Methoden angewendet werden. Die ITC wurde zur Validierung der Funktionalität der Zielproteine eingesetzt. Dabei wurden die mittels Titration eines bekannten Liganden ermittelten Affinitäts- und Stöchiometriewerte mit Literaturwerten für verschiedene Zielproteine verglichen. Mit dem verwandten Verfahren der dynamischen Differenzkalorimetrie (DSC) wurde überprüft, ob die Schmelztemperatur des Proteins Tm deutlich oberhalb der Temperatur des Experiments liegt. Isolierte Kinasedomänen sind häufig nur teilweise stabil und weisen Tm-Werte im Bereich von 40 °C auf (Abbildung 1). Die Anwendung von solchen Verfahren zur Charakterisierung eines Zielproteins vor der Durchführung detaillierter mechanistischer Untersuchungen kann sich langfristig gesehen als zeit- und kosteneffektiv erweisen. Sie hilft zudem, artefaktische oder irreführende Ergebnisse durch schlechte Proteinqualität zu vermeiden. Niedrige Schmelztemperaturen von Kinasedomänen weisen u. U. auf eine niedrige Stabilität hin und verdeutlichen die Notwendigkeit verbesserter Aufreinigungsprotokolle, Lagerbedingungen und Assay-Bedingungen.
|
In der Wirkstoffforschung ist es wichtig zu wissen, ob die Anwesenheit eines anderen Liganden Einfluss auf die biologische Aktivität einer Prüfsubstanz hat. Ein zweiter Ligand kann entweder keinen Einfluss auf die Aktivität der Prüfsubstanz haben, kann direkt oder indirekt mit der Bindung der Substanz konkurrieren oder kann sogar erforderlich sein, damit die Prüfsubstanz ihre Wirkung entfalten kann.
Die Kenntnis des Wirkmechanismus der Prüfsubstanz kann hilfreich sein, um die zelluläre Aktivität bei Substratkonzentrationen zu interpretieren bzw. vorherzusagen, die sich von den zur Messung der IC50-Werte verwendeten Konzentrationen unterscheiden. Sie kann auch Einblicke in die Bedeutung von 3D-Strukturen geben, die für verschiedene intermolekulare Komplexe ggf. gelöst werden können. Informationen zum Wirkmechanismus können auch dazu verwendet werden, nachfolgende Assays zu entwickeln, die auf einen bestimmten intermolekularen Komplex abzielen. Kinaseinhibitoren können bevorzugt an nicht aktive Konformationen des Kinaseproteins binden bzw. solche Konformationen induzieren. Der Vergleich der Bindungsaffinität einer Prüfsubstanz für jede dieser Formen hilft bei der Entscheidung, ob die Entwicklung von Substanzen, die an die aktive oder nicht aktive Form des Proteins binden, weiterverfolgt werden soll. Derartige Entscheidungen wirken sich auf die nachfolgenden Prozesse in der Kinasewirkstoffforschung aus.
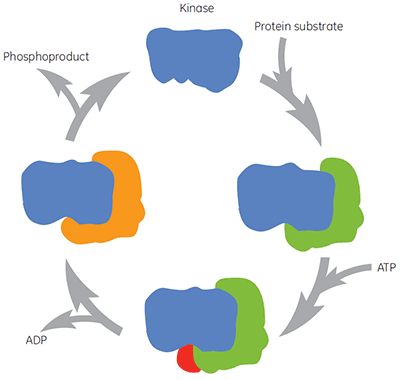
Wie alle therapeutisch wichtigen Enzyme sind Kinasen nicht einfach ein einzelnes molekulares Target für die Substanzintervention. Während des katalytischen Zyklus bindet die Kinase an Proteinsubstrat, ATP, Zwischenstoffe und Produkte (Abbildung 2). Diese unterschiedlichen Enzymformen können auch in vielen verschiedenen Konformationen vorliegen. Es existieren somit unterschiedliche Formen des Enzyms vor, auf das Substanzen ausgerichtet werden können bzw. für das unterschiedliche biochemische Assays angepasst werden können. Die physiologische Konzentration von ATP liegt bei ca. 2 mM. ATP kann somit häufig sehr effektiv mit Substanzen konkurrieren, die an die ATP-Bindungsstelle binden. Daher ist die Suche nach Substanzen, die vor oder nach ATP binden („nicht kompetitive Substanzen“) oder die nur nach ATP binden („unkompetitive Substanzen“) ein attraktiver Ansatz für die Kinasewirkstoffforschung. Viele klassische Kinaseinhibitoren wirken auf die ATP-Bindungsstelle des Enzyms. Daher ist hinsichtlich der Bindung an das Enzym eine Konkurrenz mit ATP zu erwarten. Andere Substanzen wirken u. U. auf allosterische Bindungsstellen. In diesem Fall ist eine solche Konkurrenz mit ATP nicht zu erwarten. Durch die Charakterisierung des Wirkmechanismus von Substanzen kann festgestellt werden, ob die Affinität der Prüfsubstanz durch die Anwesenheit von ATP oder auch Proteinsubstrat erhöht oder verringert wird oder unbeeinflusst bleibt. Solche Untersuchungen sind wertvoll für das Verständnis der Struktur-Wirkungs-Beziehungen (SAR) auf molekularer Ebene. Sie bilden zudem die Grundlage für die Suche nach neuen Pharmakophoren.
|
Enzymkinetische Assays sind üblicherweise nicht so konfiguriert, dass sie bestimmte Enzymformen besetzen, die entlang des Reaktionswegs auftreten. Demzufolge ist es bisweilen schwierig, direkte Informationen zur relevanten Enzymform für maximale Affinität zu erhalten. Die ITC kann diese Einschränkung überwinden, indem sie die Bindungsaffinitäten an unterschiedliche, vorher festgelegte Enzymformen misst. Die Bindung an freie Enzyme ist der einfachste Ansatz. Die ITC-Bedingungen können jedoch auch für die Untersuchung anderer Enzymformen konfiguriert werden. Dazu gehören Enzym-Protein-Substrate, Enzym-ATP, Enzym-ADP und Enzym-Phosphoprodukt-Komplexe, abhängig vom Mechanismus der Katalyse. Die Verwendung nicht hydrolysierbarer ATP-Analoga kann auch zur Untersuchung einer potenziellen Substanzbindung an den ternären Enzymkomplex mit beiden Substraten hilfreich sein.
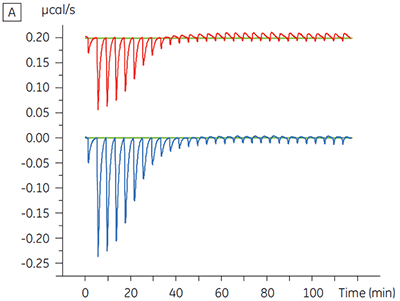
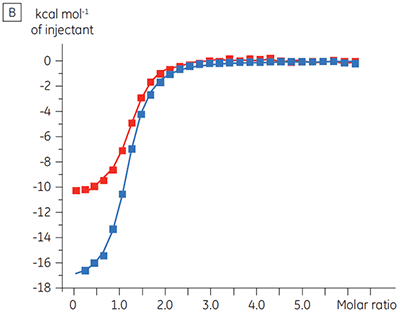
Für ein Proteinkinase-Target wurden Experimente zur Charakterisierung des Einflusses von ATP auf die Bindung einer Prüfsubstanz durchgeführt. Mit dem Malvern MicroCal™ VP-ITC wurden ITC-Titrationen einer Prüfsubstanz in Gegenwart und in Abwesenheit von 100 µM ATP durchgeführt - dies entspricht ca. dem 60-fachen des KD-Werts für ATP (Abbildung 3).
|
|
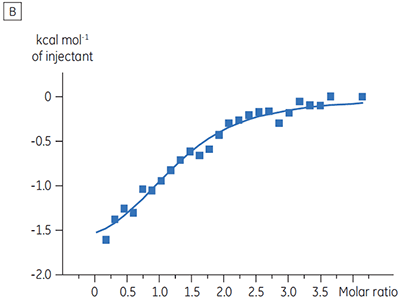
Die ITC-Ergebnisse zeigen deutlich, dass keine Änderung der Affinität der Bindung der Substanz an die Kinase erfolgt, wenn ATP mit dem Protein in die Zelle eingeschleust wird. Die Enthalpiewerte verdeutlichen, dass trotz der fehlenden Auswirkung auf die Affinität eine erhebliche Auswirkung auf die Enthalpie der Bindung vorliegt. Diese Ergebnisse deuten somit darauf hin, dass die Substanz in Bezug auf die ATP-Bindung nicht kompetitiv ist und dass es in Gegenwart von ATP zu Änderungen des Bindungsmodus kommen kann. Sie machen deutlich, dass die ITC nicht nur bei der Charakterisierung von mechanistischen Details der Substanzbindung hilfreich ist, sondern aufgrund der dualen Messfunktion des Verfahrens auch bei der Messung der Affinität und der Bindungsenthalpie. In einem ähnlichen Experiment wurde in Bezug auf ATP eine unkompetitive Kinetik beobachtet. Dies betraf die Bindung einer anderen Prüfsubstanz an dieselbe Proteinkinase. Der KD-Wert in Abwesenheit von ATP betrug > 50 µM (im ITC-Standarddurchlauf nicht messbar); in Gegenwart von ATP hingegen wurde der Wert mit 0,7 µM gemessen. (Abbildung 4).
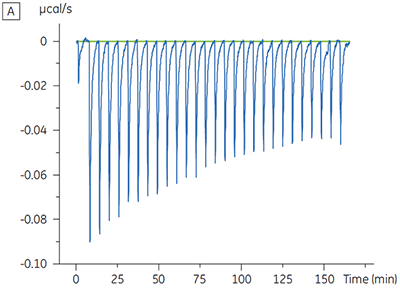
|
|
Der Vorteil der Möglichkeit einer direkten Überwachung der Bindung an einzelne Proteinkomplexe wurde auch in einem anderen Beispiel gezeigt. Hier wurde für einen Komplex aus zwei aufeinanderfolgenden Kinasen in einem Signalübertragungsweg eine hochaffine Substanzbindung vermutet. Die ITC ermöglichte die Untersuchung der Bindung der Substanz an die Upstream-Kinase alleine als auch an einen Komplex aus den Upstream- und Downstream-Kinasen. Dabei wurde zuerst gezeigt, dass dieser Komplex tatsächlich gebildet wurde. Für die Bindung der Substanz an den Komplex wurde eine Erhöhung der Affinität um das Fünffache gezeigt (Abbildung 5).
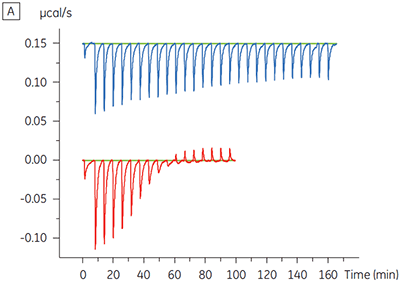
|
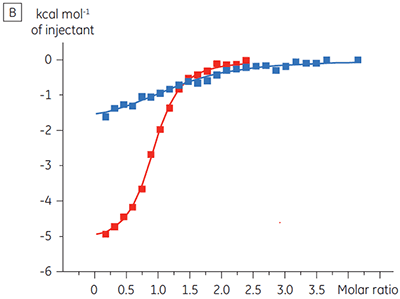
|
Kalorimetrische Methoden haben sich bei Untersuchungen der Proteinkinaseinhibition als nützlich erwiesen. Sie vereinfachen die Qualitätskontrolle von Zielproteinen und tragen auch zur Aufklärung und zum Verständnis der Bindungsmechanismen von Inhibitoren bei.
Das Aufkommen von automatisierten Geräten mit hohem Durchsatz, wie den Systemen MicroCal Auto-iTC200 und MicroCal VP-Capillary DSC von Malvern, hat diese Anwendungen attraktiver gemacht. Aufgrund des fortgesetzten Trends zu niedrigerem Reagensverbrauch werden kalorimetrische Methoden im rationalen Wirkstoffdesign auch weiterhin ihren Platz behalten.
Geoff Holdgate, Principal Scientist, Global Compound Sciences, Lead Generation - Discovery Capabilities & Sciences, Astra Zeneca Pharmaceuticals, Mereside, Alderley Park, Macclesfield, SK10 4TG, UK