サイズ排除クロマトグラフィー(SEC)は、生物化学の分野で一般的に利用されるツールである。 従来の SEC では、分子量が分かっている標準試料の溶出時間と、未知の試料の溶出時間を比較することで、未知の試料の分子量を決定する。 このとき、UV 検出器または、屈折率(RI)検出器のどちらかを、濃度検出器として単独で用いる。 これに対し、高度なマルチ検出 SEC システムでは、UV 検出器、RI 検出器、光散乱検出器、固有粘度検出器の、最大で 4 種類の検出器を備える。 光散乱検出器では、カラムのキャリブレーションを行わずに、散乱光強度から直接、分子量を測定することができる。 粘度検出器で測定される固有粘度は、分子密度の指標であり、そこから分子の構造変化を推定することができる。 光散乱と固有粘度を組み合わせることで、分子の大きさを計算することができる。
これら 4 つすべての検出器において、最大の応答感度を維持するには、配管を分岐せず、各検出器を直列に接続することが重要である。
分子生物学研究の分野で、膜タンパク質の研究がますます頻繁に行われるようになってきている。 結晶化によるタンパク質構造の評価は、この研究の主要目標の 1 つであるが、こうしたタンパク質の結晶化は難しい。 膜タンパク質の結晶化は、タンパク質の純度や界面活性剤の濃度や種類など様々な要素に左右される。 膜タンパク質複合体の界面活性剤を除去しすぎると、タンパク質の分解を招き、結晶化の可能性が低くなることがある。 精製した膜タンパク質中のタンパク質と界面活性剤の割合を明らかにし、最適化することで、結晶化の可能性について、またタンパク質と界面活性剤の複合体(PDC)のタンパク質含有量について貴重な情報を得ることができる。
本アプリケーションノートでは、精製した、多剤耐性に関わる細菌膜タンパク質について、屈折率(RI)検出器、紫外線(UV)検出器、光散乱(LS)検出器、固有粘度(IV)検出器を備えたサイズ排除クロマトグラフィーシステムである、Viscotek TDAmax を使用して特性評価した。
試料を、界面活性剤である n-ドデシル-β-D-マルトシド(DDM)の存在下で精製した。 0.02% w/v DDM を加えた PBS を移動相とし、試料を GE Superdex 200 SEC カラムで分離した。
OmniSEC によるコポリマー分析を行い、タンパク質と界面活性剤の dn/dc と dA/dc(吸光係数)を基に、クロマトグラム上の各点での複合体の分子量と、両成分の濃度を計算した。 タンパク質の dn/dc は 0.185ml/g とした。 タンパク質の吸光係数は、0.5 と推定した(A280; 1mg/ml)。 これまでの研究から、DDM の dn/dc は 0.1608ml/g であることが分かっており、その吸光係数の測定値は 0.0044 であった(A280; 1mg/ml)。
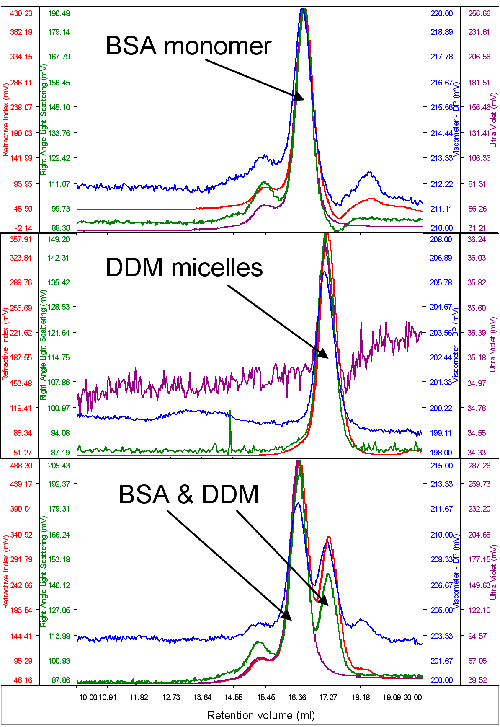
一般的に、分析には極めて少量の精製タンパク質しか使用できない。 このため、まずは、タンパク質と界面活性剤ミセルの挙動を、典型的な標準タンパク質である、ウシ血清アルブミン(BSA)を使って分析した。 BSA の分子量を使用して、検出器を校正した。 次に、純度の高い DDM ミセルを十分な量流し、その分子量と大きさを測定した。 図 1 は、BSA、DDM、その両方のクロマトグラムである。
|
まず、2 つの試料は明らかに異なる保持容量で溶出し、それら 2 つの間には十分な分解能が得られている。 次に注目すべき特徴は、BSA が UV 検出器(280nm)でかなりの吸収を示すのに対し、DDM からの信号は非常に低いことである。 このことは、2つの試料を単体で流したときのクロマトグラムと、2つの試料を合わせて流したときのクロマトグラムから明らかである。
BSA の分子量は正確に 67kDa と測定された。 DDM ミセルの分子量と大きさは、単体で測定したところ、それぞれ 60kDa と 2.5nm であった。 BSA と DDM を合わせて測定した場合は、DDM の分子量のわずかな増加が認められた(65kDa)。これは、2 つのピーク間の分解能の限界による影響と考えられる。
BSA と DDM がこのシステムで問題なく流れることを確認したため、 膜タンパク質を注入した。 タンパク質濃度は 0.5mg/ml 、注入量は 100μl とした。
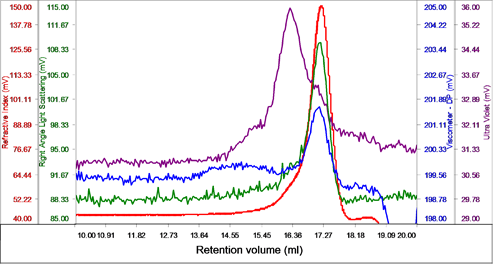
RI 検出器によると、この試料は上昇側に肩を持つ、単一のピークとして溶出している。 この肩状部分は、UV 信号のピークに対応し、これがタンパク質と界面活性剤の複合体(PDC)であることが特定される。一方、RI のピークには UV 信号はほとんどなく、これが DDM ミセルであることが示唆される(図 2)。
|
ピークの UV 吸収のない部分の分子量と大きさを測定したところ、それぞれ 62.5kDa、2.6nmであり、それが DDM ミセルであることが特定された。
RI の肩状部分( UVの ピーク部分)の分子量は 74.5kDa で、タンパク質と界面活性剤の複合体、PDC と特定された。 この混合物を分析したところ、PDC を構成する DDM の割合は 21.6% と計算されたのに対し、遊離 DDM ミセルは試料の 78.4% を占めていた。 また、PDC はタンパク質を 46%、DDM を 54% 含有していた。
タンパク質の分子量は 33kDa であることが分かっていた。 これは PDC の分子量(74.5kDa)の 44% であり、タンパク質が PDC の 46% を占めるという計算に非常に近く、得られた結果が優れている証拠となる。
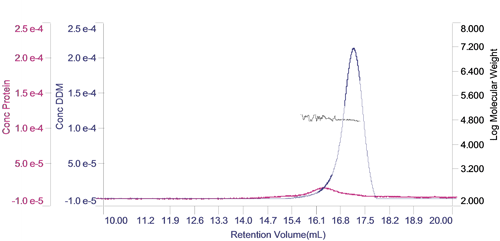
2 つの成分それぞれの濃度を計算し、横軸に溶出体積を取ったクロマトグラムとして表示することもできる。 これにより、試料の組成を分かりやすく視覚的に表示することができる。 この場合、タンパク質の濃度が DDM ミセルの濃度に比べ、はるかに低いことが分かる。 さらに、DDM の大部分が PDC ではなく遊離ミセルとして存在していることが明らかである。 2 つのピークにおける分子量も、このクロマトグラム上に示している。
|
ここでは Viscotek TDAmax システム(図 4)を使用して、細菌多剤耐性膜タンパク質を界面活性剤である DDM の存在下で精製したときに生じるタンパク質と界面活性剤の複合体の特性評価を行った。 また、PDC と遊離 DDM ミセルの分子量を測定した。 さらに、PDC の組成を、タンパク質と DDM の含有量という観点で測定し、測定値が予測値に非常に近いことが分かった。

|