このアプリケーションノートでは、有効性と、身体での取り込み、分解、および排出の各速度を測定する目的で、ナノ粒子トラッキング解析(NTA)を使用して、薬物送達に使用されるリポソームなどのナノ粒子の径と濃度を測定する方法について説明します。
薬物送達におけるナノ粒子の使用は、急速に増加し続けています。 ナノ粒子は、薬物動態学的特性、放出の制御と維持、および対象とする特定の細胞、組織、器官の指定の面で非常に優れています。 ナノ粒子による薬物送達に対する感心が高まっている理由の1つとして、疾患治療に活用できる生物学的な活性化合物の新規発見率が低下していることもあります。 毎年市場に投入される新規薬品が減少するのに伴い、ナノ粒子の多目的で多機能の構造を薬物送達に使用することへの感心が急速に増大しています。 これらすべての特徴は、既存の薬品の有効性を向上する可能性を有しています(Malam ら、2011年)。
薬物送達に使用するナノ粒子は、多様な組成を持つ各種の材料から構成可能なサブミクロンサイズのコロイド系として定義されていました。 一般的に定義されるナノ粒子ベクターとして、リポソーム、ミセル、デンドリマ-、固形脂質ナノ粒子、金属ナノ粒子、半導体ナノ粒子、ポリマーナノ粒子があります。 このように多様な形態で、ナノ粒子は特定の細胞/組織に薬品、遺伝子、ワクチン、および診断を送達するために広範に使用されてきました (Ramら、2011年)。
ナノ粒子による薬物送達系を検討するときに、ナノ粒子の径は主要なパラメーターです。これは、身体での送達、取り込み、分解および排出のプロセスに直接影響するからです。 例えば、粒子径が30 nmから数百nmの範囲にあるナノ粒子は脈管構造の漏れにより腫瘍部位に蓄積されてしまうことがあり、食作用は500 nmを超える粒子を好みます。一方、胆管と腎臓での排出はそれぞれ、30 nm未満と8 nm未満の粒子で起こります。 さらに肝臓は、大きい粒子(200 nmと300 nm)と比較して、小さい粒子(25 nmと50 nm)で取り込みが低くなります。 このため、多くの系やプロセスについて、投与する粒子を正確に測定することが重要です。
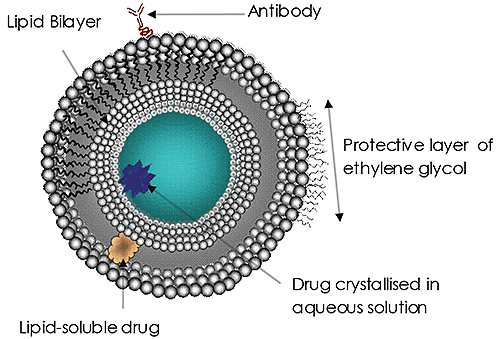
リポソーム(図1)は長い間、重要な研究開発業務の対象であり、現在は一般的に着目されている薬物送達系です。 リポソームは、真菌や原生動物による感染に対してアンホテリシンB、乳ガン治療用のドキソルビシン、およびA型肝炎とインフルエンザのワクチンについて、送達系として認証されています。 薬物送達におけるリポソームの使用と可能性は、重要度を増し続けています。 この理由は明らかです。
使用するリポソームの粒子径が治療の有効性の重要な因子の1つであるという認識が高まっています。 薬物送達リポソームの粒子径は、血液中での循環滞留時間、ターゲティングの有効性、細胞吸収(エンドサイトーシス)率、および最終的には意図どおりのペイロードの放出に影響する可能性があります。 このような粒子の検討が、すべてのナノ粒子薬物送達系で非常に重要です。
|
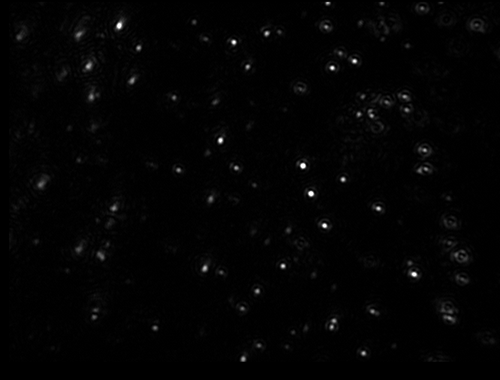
マルバーンのナノサイト装置シリーズは、水その他の溶媒中に存在するリポソーム粒子について、正確かつ短時間で径と個数を測定します。 必要な量は少なく、試料調整もほとんど不要です。 この装置を使用すると、懸濁液中の個々のリポソームを視覚化でき、ブラウン運動を追跡できます。これにより、個々の粒子に基づいて粒度分布を数秒で得ることができます。
|
粒子径と濃度だけでなく、NTAは次のパラメーターも同時に、また粒子ごとに提供します。
ポリβ-アミノエステル(PBAE)は、様々なガンに対する遺伝学的治療の薬物送達系になる可能性を有しています。 組み合わせ経路により、ポリマーとDNAの多数の組み合わせを作製できる点で、他の系よりも有利です。 また、加水分解により急速な放出特性を持ちますが、投与、製造、および保管が困難になります。 凍結乾燥が代表的な保管方法であり、NTAはPBAE-DNAナノ粒子の凝集(粒子径の増加)と破壊(粒子径の減少)に対する凍結乾燥の影響を評価する目的に使用されてきました(Tzengら、 2011、およびSunshineら、 2012)。
ポリ乳酸グリコール酸(PLGA)は、FDA認証済みの薬物送達系です。 この物質は乳酸とグリコール酸に分解し、それらは両方とも身体の代謝経路の終点です。 PLGAは、アモキシシリンの薬物送達系、また進行性前立腺ガンの治療に使用するゴナドロピン放出ホルモンの薬物送達系として使用されてきました。 投与レベル、および毒性の副作用を低減する目的で、免疫抑制薬のミコフェノール酸がPLGAのカプセルに入れられてきました。 良好な送達が確実に行われるために重要なパラメーターであるこれらのナノ粒子の径を測定し、複数の研究結果を比較可能にする目的で、NTAが使用されました(Shiraliら、 2011)。
意図どおりに細胞膜を超えて分子が輸送されることが、送達の重要点です。 多くの場合、分子単体では細胞膜に侵入できないため、効率的な担体が必要です。 Sokolovaら (2012)は、NTA、動的光散乱(DLS)、電子顕微鏡(EM)などの多数の手法を使用して、細胞膜を通過する大小分子の多機能担体として、リン酸カルシウムのナノ粒子(直径は100~250 nmで機能付与によって異なる)を調べました。
Ohlssonら (2012)は、リポソームの安定性と完全性を検査する目的でNTAを使用して、100 ms未満の時間スケールで個々のタンパク質リポソームが脂質二重層膜を通過する溶質輸送について報告しました。
遺伝子送達媒体としてのナノ粒子の研究で、Ghonaimとその共同研究者は、各種の非ウイルスのプラスミドDNAおよび低分子干渉RNAの送達系におけるリポポリアミンおよびスペルミンの化学的性質を改変する効果に関する研究で、NTAの使用について幅広く報告しました(Ghonaimら、2007a。Ghonaimら、2007b。Ghonaimら、2007c。Ghonaim、2008。Ghonaimら、2009。Soltanら、2009。Ghonaimら、2010)。 同様に、Ofekら(2010)は、低分子干渉RNAの送達に使用する樹脂状ナノ担体の特性評価にNTAを使用し、Bhiseは細胞培地での遺伝子送達ポリマーの研究で、NTAを使用して粒子径と粒度分布を測定しました(Bhiseら、2010)。 Bhiseは最近、さらにこの研究を推し進め、ポリマーナノ粒子のカプセルに入っているプラスミドの個数の定量法を開発しました。この研究で、BhiseはNTAを使用して、100 nmのナノ粒子当たりのプラスミドの個数密度を測定しました(Bhiseら、2011)。
Weiら (2012)は、ナノ医学の進歩における課題と可能性の調査で、ナノ粒子の径、形状および組成の特性を正確に評価する信頼性の高い方法の必要性、および不特定の細胞毒性を低レベルに維持し、保管時の安定性を増加するための粒子操作の必要性を示しました。
ナノ粒子薬物送達系について、NTAによる粒子径の測定と計数の重要性を示すその他の例が報告されています(Hsuら、2010。Parkら、2010。Tagalakisら、2010)。
1. Bhise NS, Gray RS, Sunshine JC, Htet S, Ewald AJ and Green JJ (2010) The relationship between terminal functionalization and molecular weight of a gene delivery polymer and transfection efficacy in mammary epithelial 2-D cultures and 3-D organotypic cultures, Biomaterials, doi:10.1016/j.biomaterials.2010.07.023
2. Bhise NS, Shmueli RB, Gonzalez J and Green JJ (2011), A Novel Assay for Quantifying the Number of Plasmids Encapsulated by Polymer Nanoparticles. Small. doi: 10.1002/smll.201101718
3. Ghonaim HM, (2008) Design and Development of Pharmaceutical Dosage Forms for Gene and siRNA Delivery, PhD Thesis University of Bath, Department of Pharmacy and Pharmacology, September 2008
4. Ghonaim HM, Li S and Blagbrough IS (2010) N1,N12-Diacyl Spermines: SAR Studies on Non-viral Lipopolyamine Vectors for Plasmid DNA and siRNA Formulation Pharmaceutical Research, Vol 27, (1) p17-29
5. Ghonaim HM, Li S, Soltan MK, Pourzand C and Blagbrough IS (2007a), Chain Length Modulation in Symmetrical Lipopolyamines and the effect on Nanoparticle Formulations for Gene Delivery, in British Pharmaceutical Conference BPC2007, Manchester, 10th Sept.
6. Ghonaim HM, Li S, Pourzand C and Blagbrough IS (2007b), Efficient Novel Unsymmetrical Lipopolyamine Formulations for Gene Delivery, in British Pharmaceutical Conference BPC2007, Manchester, 10th Sept.
7. Ghonaim H M, Li S, Pourzand C and Blagbrough IS (2007c), Formulation and Delivery of Fluorescent siRNA by Lipospermine Nanoparticle Complex Formation, in British Pharmaceutical Conference BPC2007, Manchester, 10th Sept.
8. Ghonaim H, Li S and Blagbrough IS (2009) Very Long Chain N4 , N9 -Diacyl Spermines: Non-Viral Lipopolyamine Vectors for Efficient Plasmid DNA and siRNA Delivery Pharmaceutical Research, Volume 26, Number 1, p19-31
9. Hsu J, Serrano D, Bhowmick T, Kumar K, Shen Y, Kuo Y C, Garnacho C and Muro S (2010) Enhanced Endothelial Delivery and Biochemical Effects of α-Galactosidase by ICAM-1-Targeted Nanocarriers for Fabry Disease Journal of Controlled Release, Article in Press, doi:10.1016/j.jconrel.2010.10.031
10. Malam Y, Lim E and Seifalian A (2011) Current trnds in application of nanoparticles in drug delivery, Current Medicinal Chemistry, Volume 18, Number 7, March 2011, pp.1067-1078 (12)
11. Ofek P, Fischer W, Calderon M, Haag R and Satchi-Fainaro R (2010) In vivo delivery of small interfering RNA to tumors and their vasculature by novel dendritic nanocarriers. FASEB J..doi 10:1096/fj.09-14964
12. Ohlsson G, Tabaei S, Beech JP, Kvassman J, Johansson U, Kjellbom P , Tegenfeldt JO and Höök F(2012) Solute transport on the sub 100 ms scale across the lipid bilayer membrane of individual proteoliposomes, Lab Chip, 2012, Accepted Manuscript, DOI: 10.1039/C2LC40518K
13. Park J, Gao W, Whiston R, Strom T, Metcalfe S and Fahmy TM (2010) Modulation of CD4+ T Lymphocyte Lineage Outcomes with Targeted, Nanoparticle-Mediated Cytokine Delivery, Mol. Pharmaceutics, 2011, 8 (1), pp 143-152
14. Ram M, Yaduvanshi KS, Yadav H, Singh N, Mangla G, Shivakumar H (2011) Nanoparticles, Promising Carriers in Drug Targeting: A review current drug therapy, Volume 6, Number 2, May 2011, pp.87-96(10)
15. Reshetov et al, Photochem Photobiol. 2012 Sep-Oct;88(5):1256-64. doi: 10.1111/j.1751-1097.2012.01176.x
16. Shirali, et al. Am J Transplantation. 2011; 11: 2582-2592
17. Sokolova V, Rotan O, Klesing J, Nalbant P, Buer J, Knuschke T, Westendorf AM and Epple M (2012) Calcium phosphate nanoparticles as versatile carrier for small and large molecules across cell membranes, Journal of Nanoparticle Research, Volume 14, Number 6 (2012), 910, DOI: 10.1007/s11051-012-0910-9
18. Soltan MK, Ghonaim HM, El Sadek M, Kull MA, El-aziz LA and Blagbrough IS (2009) Design and Synthesis of N4, N9-Disubstituted Spermines for Non-viral siRNA Delivery - Structure-Activity Relationship Studies of siFection Efficiency Versus Toxicity, Pharmaceutical Research, Volume 26, Number 2, p 286-295
19. Sunshine et al. PLoS ONE, 2012; 7(5):e37543. doi:10.1371 /journal. Pone .0037543
20. Tagalakis A D, Grosse S M, Meng Q-H, Mustapa M F M, Kwok A, Salehi S E, Tabor A B, Hailes H C and Hart S L (2010) Integrin-targeted nanocomplexes for tumour specific delivery and therapy by systemic administration, Biomaterials, Vol 32, Issue 5, February 2011, p1370-6
21. Tzeng et al. Biomaterials. 2011 August; 32(23): 5402-5410. doi:10.1016/j.biomaterials.2011.04.016
22. Wei A, Mehtala JG and Patri AK (2012) Challenges and opportunities in the advancement of nanomedicines, Journal of Controlled Release, http://dx.doi.org /10.1016/j.jconrel.2012.10.007