DSCデータを使用し、タンパク質プロセス開発時の抗体キャプチャーステップで最も安定した溶出条件を特定し、コストの節約を実現しました。
バイオ医薬品プロセス開発は、コストも時間もかかることがあります。 最終的な目標は、コスト効率の最も高い、再現可能かつ堅牢なルートで精製した製品の収量を最大化することです。 バッチ処理に失敗すると、予算面で打撃を受ける可能性もあります。そのため、バイオ医薬品の商品化に際しては、調査から臨床展開、商用生産に至る開発工程全般でタンパク質の安定性を徹底的に把握しておく必要があります。
タンパク質バイオ医薬品の安定性と活性構造を、その投与時点まで維持することが不可欠です。 これを実現する手段の1つとして、バイオ医薬品の物理的な挙動を理解するための安定性試験を挙げることができます。 タンパク質は通常、その複雑さやデリケートな構造から、必然的に安定性の問題を抱えています。 安定性試験では、pH、温度、イオン強度など、さまざまな環境因子がタンパク質構造の全体性に与える影響を判別します。この構造の全体性は、生物学的活性に直接影響します。したがって、この試験はプロセス開発に必要不可欠な要素です。 このストレス試験は、分子の弱点を明らかにし、重要な特性を識別する上で役立ちます。また、適切な緩衝液、pH、イオン強度、添加剤を選択することで変性メカニズムを特定し、効果的な対策を講じるための合理的な手法も提供します。
|
精製方法の開発と並行して安定性試験を行うと、より効果的な手法を設計できます。 精製プロセスの開発時に安定性試験を行うと、次のことが可能になります。
安定性試験は、安定性を指標とする信頼性の高いアッセイ開発にも役立ちます。 これらのデータを使用すると、典型的な製剤開発プロセスで検討する必要がある条件の範囲を絞り込むことで、医薬品の調製を加速できます。 これにより、リソース、コスト、時間の節約になります。
このアプリケーションノートでは、示差走査型カロリメトリー(DSC)を使用し、抗体精製プロセスの開発をガイドする方法についてフォーカスします。 特に、プロテインAキャプチャーステップの開発時に最適な溶出条件を特定するためにDSCデータをどのように使用したかについて説明します。これにより、初期の臨床生産スケールにおけるコストを節約できました。
DSCは、精製過程でタンパク質の安定性をモニターする方法を提供します。 これにより、プロセスやアッセイ開発中にタンパク質の異常な状態や挙動が見られても分子を保護できるように条件が改善されます。
PD-10脱塩カラム(GE Healthcare)による透析または緩衝液交換により所定の緩衝液にすべてのタンパク質を調製しました。 最終的なタンパク質濃度は約1 mg/mlでした。 測定温度範囲は5°C~90°Cで、スキャンレート1°C/minで、マルバーンMicroCal VP-DSCシステムを使用してタンパク質を解析しました。 2状態モデルまたは非2状態モデルを使用し、Origin™ソフトウェアでサーモグラムを解析しました。
プロテインAアフィニティクロマトグラフィーは、モノクロナール抗体精製の初期キャプチャーステップとしてよく使われます。 プロテインAは、多くの免疫グロブリン(lg)抗体のFc領域に結合します。 この結合特異性と選択性のおかげで、不純物がほぼない製品を1回のステップで得ることができます。 抗体分子は細胞培養で生産されますが、宿主細胞のタンパク質、核酸、培養成分を除去して、抗体分子を精製する必要があります。 細胞を除いた培養上清がプロテインAアフィニティクロマトグラフィー樹脂に添加されます。 抗体は、中性pH(pH 7付近)で固相化されたプロテインAと結合し、低pH緩衝液(たとえばpH 3.5のクエン酸緩衝液)で溶出しました。 溶出した抗体は、1 M Tris(pH 9)などの高い緩衝能を持つ溶液や低濃度の塩基
で中和されます。
プロテインAアフィニティクロマトグラフィーを使用する上で問題となることの1つが、溶出に必要な低pHで抗体や他のタンパク質が不安定になる可能性があるということです。 タンパク質が低pHで不安定になった場合、溶出中や溶出後に凝集を起こす可能性があります。
凝集は通常、タンパク質濃度に依存します。つまり、濃度が高くなれば、凝集や沈殿が起こりやすくなります。 そのため、ほとんどのクロマトグラフィーの樹脂は、培養液1リットルあたり20 g以上の抗体を結合できますが、低pHによる溶出でのタンパク質の安定性が、樹脂への投入量を制限する因子となります。 多くの抗体はpH感受性がありますが、変性
と凝集のメカニズムは構造によって異なるため、最適な安定性を得るためには複数の異なる緩衝液が必要になります。
プロテインAクロマトグラフィープロセスでの添加量と経済性を向上させるために、溶出緩衝液内でタンパク質を安定させる必要があります。 DSCはpHに応じた抗体の安定性を特定するために用いられ、どの添加剤が低pHでもタンパク質の安定性を改善できるかを判別できます。 DSCでは、転移温度(Tm)の上昇はタンパク質の安定性向上を示唆しています。 低pHの溶出緩衝液内で抗体を安定化させると、プロテインAクロマトグラフィーステップをより経済的に実行できるため、添加量を増やすことができます。
このケーススタディでは、クライアントは抗体(抗体X)の精製プロセスを改善したいと考えていました。 プロセス情報では、より多く抗体XをプロテインA樹脂に添加すると、溶出中に沈殿が生じてしまうため、初期の抗体Xの結合量はプロテインA樹脂1リットルあたり2 gに限られていました。 抗体Xの安定性に対するpHの影響を把握するために、4つの異なる緩衝液(TrisでpH 7.0に調整したクエン酸緩衝液、pH 7.3のリン酸緩衝液、pH 3.5のクエン酸緩衝液、pH 5.0のクエン酸緩衝液)にタンパク質を調製しました。 DSCデータ(表1)から、pH 7.0とpH 7.3の抗体XはpH 3.5よりも高いTm値を示していました。これは、タンパク質が高めのpHでより安定することを示しています。 アンフォールディング開始温度も、pH 7.0とpH 7.3ではpH 3.5より高い値でした。 pH 5.0での抗体XはpH 7.0と同等のTm値を持っており、アンフォールディングの開始温度(Onset)は低めでした。このことは、pHがこの抗体のアンフォールディングで主要な役割を果たしていることを示唆します。
| 主な転移のTm | アンフォールディングのOnset温度(°C) | |
|---|---|---|
| クエン酸-Tris緩衝液(pH 7.0) | 68.7 | 60.1 |
| PBS(pH 7.3) | 69.5 | 58.5 |
| クエン酸(pH 5.0) | 71.5 | 48.2 |
| クエン酸(pH 3.5) | 59.3 | 34.1 |
| クエン酸+マンニトール(pH 3.5) | 64.7 | 41.0 |
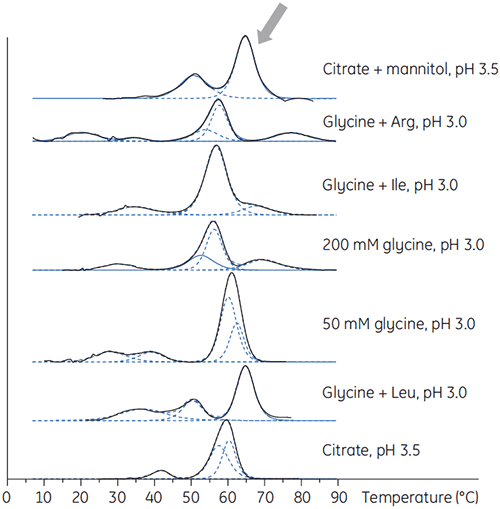
抗体Xは低pH緩衝液に種々の添加剤を加えたものを準備しました。これにより、添加剤のいずれかが低pHで抗体を安定化できるかどうかを確認できます。 DSCを用いてどの条件が抗体のTmを向上させるかについて確認しました(図2)。
|
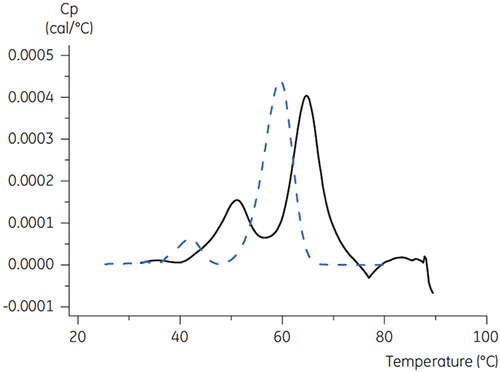
抗体Xでは、pクエン酸+マンニトール(pH3.5)が、最大のTmシフトをもたらし、最も好ましい安定性を示しました。 マンニトールを添加すると、pH 3.5のクエン酸の条件と比べてTm値とOnset温度の両方が向上しました。 (図3)
|
これらのDSCの結果は、プロテインAアフィニティ樹脂で溶出緩衝液にマンニトールを添加すると、抗体Xの安定性が向上したことを示唆しています。 溶出中に抗体の安定性が向上すると、プロテインAクロマトグラフィー樹脂への抗体の添加量を増加させることができます。
DSCから得られたタンパク質安定化情報をプロセス開発で利用することで、プロテインAキャプチャーステップにおける抗体Xの添加量が増加しました。 クエン酸+マンニトールをタンパク質溶出緩衝液として使用すると、プロテインA樹脂1リットルあたり15 g以上の抗体Xをキャプチャーできるようになり、クエン酸緩衝液のみのときより7.5倍以上に増加しました(クエン酸緩衝液のみの場合は1リットルあたり2 g)。
プロテインAキャプチャーステップの後の抗体Xは、当初のプロセスよりも濃縮されていました。これにより、限外ろ過/血液透析ろ過手順がなくなり、材料やプロセス時間の削減につながりました。
このアプリケーションノートでは、DSCデータを使用し、タンパク質のプロセス開発時の抗体キャプチャーステップで最も安定した溶出条件を特定しました。 DSCは、クロマトグラフィーの開発を進める前に、タンパク質を安定化させる緩衝液条件を選択するための貴重な情報を提供します。 精製プロセスの開発でこの重要なステップのパフォーマンスを向上させることができれば、最終的にコストを大幅に削減できるようになります。
このアプリケーションノートの著者はPrathima Acharya(以前はDiosynth Biotechnologyに勤務)です。 Rochelle Bazemore、Sorina Morar、Sue Cook、Jessica Weaver(Purification Development Group)の協力に感謝いたします。