このアプリケーションノートでは、マルバーンMicroCal VP-Capillary DSCを使用し、プレフォーミュレーション開発で緩衝液を迅速にスクリーニングし、プロセス開発時の抗体の保存条件を最適化しました。 その結果は、時間がかかる他の手法で得られた結果とも一致していました。
抗体およびその他のタンパク質分子などのバイオ医薬品を使用した疾病の治療方法は、製薬業界で急成長している分野です。 バイオ医薬品は高濃度で複数回の投与が求められることが多いため、メーカーはキログラムまたはそれ以上の単位でタンパク質医薬品を製造する必要があります。 バイオ医薬品の製造プロセスには、何千リットルものバイオリアクター培養液を使ったタンパク質発現に加え、大規模なクロマトグラフィーカラムおよびろ過システムを使用した精製が必要になります。
調製条件に対するタンパク質の安定性、コンホメーション変化の可逆性、凝集の起こりやすさは、pHや緩衝液の組成などの因子で決まります。 調製条件、製剤、解析手法の選定を行うには、こうした因子を完全に把握しておく必要があります。 タンパク質を不安定化させる抗体精製プロセスの手順には、プロテインAカラムからの低pH溶出ステップ、ウイルス不活性化のための低pHホールドステップ、pHやイオン強度調節を伴う段階(最終製剤を含む)などがあります。
示差走査型カロリメトリー(DSC)は、変性中点温度(Tm)をモニターすることで、異なるpHおよび共溶質の条件下におけるタンパク質の熱安定性に関する情報を提供します。 Tmが高くなると、熱安定性も高くなります。これは、長期的な安定性とも相関しています。 このアプリケーションノートでは、製造プロセスで使用したプレフォーミュレーションの開発および低pHによるウイルス不活性の最適化を進めるために、Diosynth Biotechnology社が初めのpHおよび緩衝液スクリーニングの際にDSCで得られた熱安定性データを使用して抗体の安定性をどのように特性評価したかについて説明します。 低いpHによるウイルス不活性化は、タンパク質の安定性を損なわない場合、タンパク質製造にとって望ましい状態です。
DSC測定には、マルバーンMicroCal VP-Capillary DSCシステムを使用しました。 プレフォーミューション開発研究では、pH 3~8のさまざまな緩衝液を使用しました。 タンパク質(抗体X)は各緩衝液に保存し、保存直後(t = 0)および保存して1週間後(t = 1週間)の2つを用いて各種アッセイを実施しました。
精製条件を最適化するために、抗体Y(NaClとEDTAを含むpH 7.4の中性Tris緩衝液中)のDSCサーモグラムを調べ、pH 3のクエン酸緩衝液、およびpH 9.0の2 MTrisでpH 6に調整したクエン酸緩衝液とも比較しました。
MicroCal VP-Capillary DSC解析ソフトウェアを備えたOrigin™ 7.0を使用して、解析を行う前に、緩衝液のサーモグラムを各タンパク質のサーモグラムからサブトラクトしました。
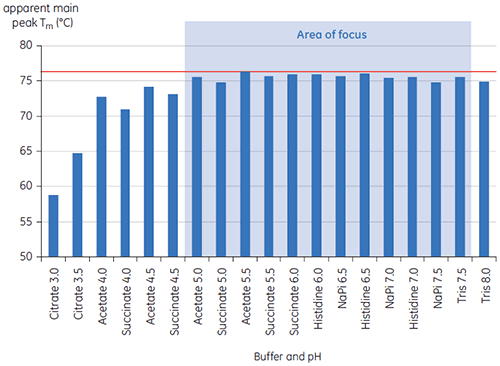
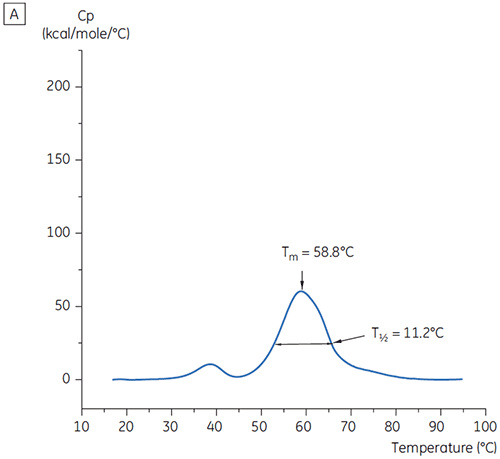
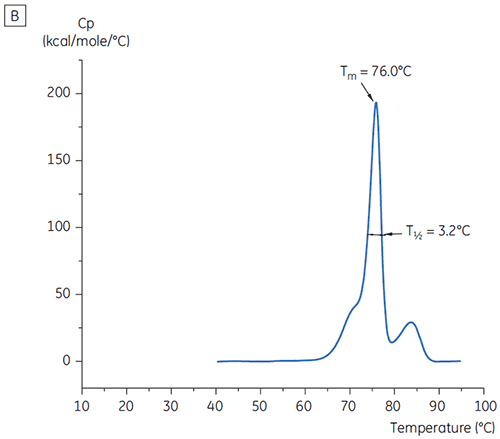
プレフォーミュレーション開発用の19の緩衝液の初期研究における、抗体Xのt = 0時点のメインTmピーク値を図1に示します。 このうち2つの緩衝液中の抗体のDSCサーモグラムを図2に示しています。 Tm値の結果から、最も安定した緩衝液条件はpH 5.0~pH 7.5にあることが判明しました。 t = 0のサンプルでは、他の解析手法(UV、サイズ排除クロマトグラフィー(SEC)、光散乱法、SDS-PAGE)は、それぞれの緩衝液条件間に見られた差異は、DSCの結果よりも小さなものでした(データ未記載)。
|
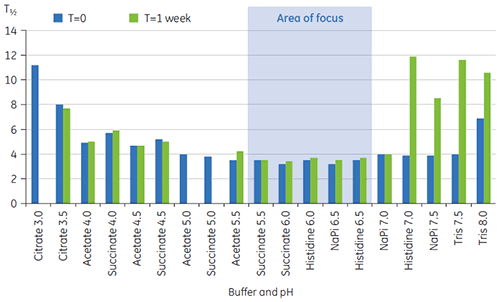
さらに条件を識別するために、図2のようにT½値を使用しました。 T½は、DSCサーモグラムの主な転移ピークの高さの半分の位置のピークの温度幅で、通常は熱転移の協同性を反映します。 低いT½値は、よりコンパクトな構造を呈している可能性があるため、調製には望ましいと言えます。 ここでは、最も低いT½値がpH 5.5~6.5の緩衝液で見られました(図3)。
|
|
|
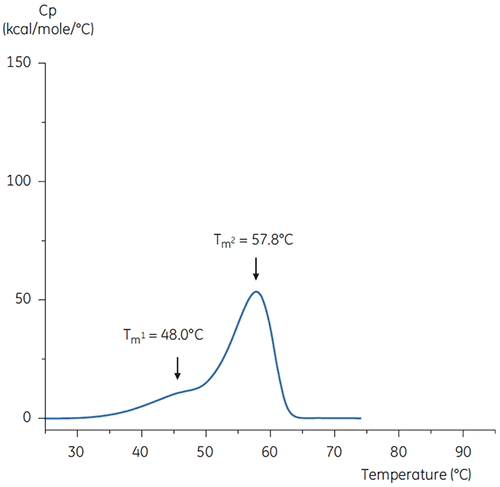
pH 3のクエン酸緩衝液は、プロテインAアフィニティカラムから抗体を溶出させる場合と、ウイルス不活性化のための低pHでのホールドステップの両方で使用できる候補です。 大部分のタンパク質は、低pHなどに長期間さらされると不安定になる傾向があるため、ウイルス不活性化ステップの直後には直ちにpHを上げる必要があります。
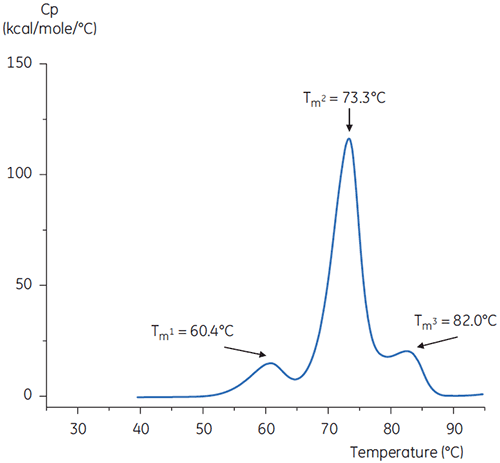
緩衝液中の抗体のDSCスキャンを図4(中性pH)と図5(pH 3)に示しています。
|
|
2つのサーモグラムの形状とパターンの違いは、pH 3.0緩衝液内で抗体の熱安定性が失われていることを示しています。 Tm2の転移のピークの高さは低く、ピーク自体も幅広いです。また、pH3の1番目の転移と2番目の転移はpH 7.4に比べて不明確です。
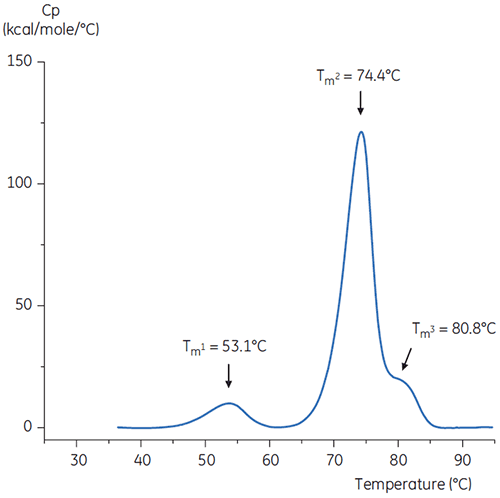
pH中性化の手順を再現するために、濃いpH 9のTris溶液で抗体溶液のpHをpH 6.0に調整しました。 その結果、抗体溶液のサーモグラムは、図6のようになりました。 ここでは、pH 3.0緩衝液よりも熱安定性が向上したことがわかります。 pH 6.0溶液内の抗体のTm2とTm3は、リファレンス緩衝液内の抗体のTm2とTm3に似ています。 pH 6内の抗体の全体的な形状、ピーク定義、ピーク幅も、pH 7.4の基準状態と近似しています。
ヒスチジンなどの安定化添加剤の存在下で中和を実施することもできます。 この場合、ヒスチジンの存在下で中和した抗体のサーモグラムも図6とほぼ同じです。これは、この抗体ではヒスチジンが有意な安定化効果をもたらさなかったことを示しています。
|
この研究では、DSCを使用すると、プレフォーミュレーション開発用にpHと緩衝液の条件を短時間で最適化できることが明らかになりました。 このデータを基に、以降の添加剤スクリーニング用に適切な緩衝液とpH幅をランク付けし、予備的な条件の数を大幅に軽減することができます。
また、DSCを使用することで、低pH不活性化ホールドステップ中およびpHを3.0から6.0に調整する以降のステップで抗体の安定性を確認することができます。 このような安定化情報は、バイオ医薬品製造のデザインおよび最適化プロセスで役立ちます。
このデータは、Dr Kathrine E.Bowers(FUJIFILM Diosynth Biotechnologies USA Inc.)の厚意により提供していただきました。 Bowers, FUJIFILM Diosynth Biotechnologies USA Inc.