このアプリケーションノートでは、キナーゼ阻害剤研究における等温滴定型カロリメトリー(ITC)の用途を主に説明しますが、創薬プロセスにおける示差走査型カロリメトリー(DSC)の役割についても触れます。
生物のキノームはゲノム内のプロテインキナーゼ一式を意味します。これらのタンパク質修飾酵素は、さまざまな治療領域において将来性のあるターゲットです。 ヒトキノームの特性を明らかにする研究は、ここ数年のキナーゼ結晶構造情報の飛躍的な増加とともに、薬剤介入のための将来性のあるターゲットとしてキナーゼがますます注目されています。
1980年代後半に製薬業界がキナーゼに着目して以降、開発されてきたほとんどのキナーゼ阻害剤は、酵素のATP結合部位を標的としています。 しかしながら、BCR-Ablキナーゼの構造変化を誘発するチロシン-キナーゼ阻害剤、Gleevec™が開発され、この分野の研究が再び活性を帯びてきました。 この薬品により、ATP結合部位以外での結合や、キナーゼ活性化の抑制など、キナーゼ阻害に取り組むための革新的なアイデアがいくつも生まれました。
酵素反応速度に関する詳細な研究は、新しいアイデアに基づく化合物の作用機序の特性を評価する上で不可欠な役割を果たしています。 その他の有用な手法の1つに、化合物とターゲットタンパク質が結合するときの完全な熱力学プロファイルを提供することができる等温滴定型カロリメトリー(ITC)があります。 測定結果から、複数の異なる酵素型(遊離酵素、酵素-基質複合体、酵素‐生成物複合体、活性酵素、非活性酵素など)に結合している化合物の親和性を比較できます。
キナーゼシグナルカスケードの阻害は、腫瘍や炎症に関連する疾病の治療で実績が証明されている方法です。 このアプリケーションノートでは、生物学的活性をもたらすキナーゼの分子間複合体を特定するためのITCアプリケーションについてフォーカスします。ITCを使用することにより、他のリガンドの存在が生物学的活性に影響を与えるかの有無についての情報を提供します。
等温滴定型カロリメトリーは、親和性(KD)、リガンド結合比(n)、結合反応のエンタルピー変化(∆H)など、さまざまな結合相互作用の特性を1回の実験で測定します。 ITC測定は迅速で、蛍光ラベリングを必要としません。また、触媒活性のないタンパク質でも測定できます(酵素反応アッセイが不要になります)。
ITC測定では通常、ターゲットタンパク質に対して一定の温度でテスト化合物を滴定し、結合反応が起こっている間の発熱または吸熱をITC装置で測定します。 創薬を目的としたプロテインキナーゼのITC測定はさまざまな観点で使用できます。
その一部を以下に示します。
タンパク質のコンストラクトやサンプル溶液の特性評価(モデルリガンドに対する正しい親和性だけでなく、正しい結合比を調べられます。このことは酵素活性測定を行わなくても機能を有するタンパク質の量を予測することができます)
アッセイ評価
生物学的活性をもたらす分子間複合体の同定。(ITCは、別のリガンドの存在がテスト化合物の生物学的活性に影響を与えるかどうかについて情報を提供できます。このアプリケーションノートではこの点にフォーカスしています。)
結合メカニズムの解析を行う前に、ターゲットタンパク質の品質管理調査を行うことは、必須ではありませんが有用です。 この調査では、タンパク質の同一性、純度、濃度、機能性、安定性を検証します。
カロリメトリーではこれらの重要な分野の2つについて適用可能です。 ITCではターゲットタンパク質の機能を、既知のリガンドを他のターゲットタンパク質に滴定して得られた文献上の親和性と結合比の値と、実際のターゲットタンパク質に既知リガンドを滴定した値とを比較し、評価しました。 関連技術である示差走査型カロリメトリー(DSC)では、タンパク質が持つ変性温度(Tm)が、結合実験の測定温度よりも十分に高いことを確認するために使われています。 単離されたキナーゼドメインは多くの場合、部分的にのみ安定しており、40°C前後にTm値を持っています(図1)。 詳細なメカニズム解析を行う前に、このようにターゲットタンパク質の特性評価を行うことは、クォリティの低いタンパク質を使用したがためのアーティファクトな影響や誤った結果を防ぐことができ、長期的に見ると時間とコストの削減につながります。 キナーゼドメインの低い変性温度は低安定性を示しており、より高品質の精製プロトコル、保管、アッセイ条件が必要となる可能性があります。
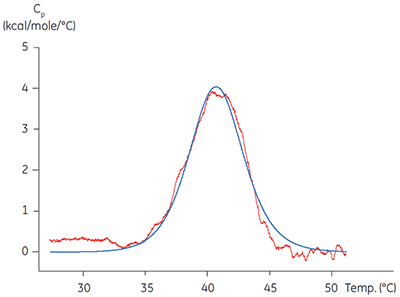
|
別のリガンドの存在がテスト化合物の生物学的活性に影響を与えるかどうかについての情報は創薬において欠かせません。 2つ目のリガンドは、テスト化合物の活性に影響しないかもしれませんし、化合物の結合に直接、または間接的に競合するかもしれませんし、またはテスト化合物が効果を発揮するために必要な可能性もあります。
テスト化合物の作用メカニズムを把握しておくと、IC50の測定とは異なる基質濃度での細胞活性の解釈または予測に役立ちます。 また、異なる分子間複合体の構造が解かれた場合、その構造情報の妥当性についても検討できます。 作用メカニズムの情報は、引き続き行われる特定の分子間の複合体をターゲットとしたアッセイを考案するためにも使われます。 キナーゼ阻害剤は、キナーゼタンパク質の非活性構造に結合するか、非活性構造を誘発する可能性があります。 これらのそれぞれの構造に対するテスト化合物の結合親和性を比較することも、活性または非活性型のタンパク質のどちらに結合している化合物の開発を進めるかを判定する上で重要です。 このような決定はその後のキナーゼ創薬プロセスに影響します。
治療面で重要なすべての酵素と同様に、キナーゼは単に1ヵ所の分子ターゲットに対し、化合物が介入するわけではありません。 酵素反応サイクルの間、キナーゼは基質タンパク質、ATP、中間体、生成物に結合します(図2)。 これらの異なる酵素様式は、多くの異なるコンフォメーションをとる可能性があります。 したがって、酵素の複数の異なる様式に化合物が結合したり、様々な生化学的アッセイにバイアスがかかることがあります。 ATPの生理学的濃度はおよそ2 mMです。これはATP結合サイトへ化合物が結合する際は、必ずATPと競合することを意味します。 よって、ATPの前後(非拮抗阻害)に化合物がキナーゼに結合するのか、またはATPの結合後のみなのか(不拮抗阻害)を調べることは、キナーゼの創薬アプローチとしてどちらも興味があります。 しかしながら、従来のキナーゼ阻害剤の多くは酵素のATP結合サイトをターゲットとしており、ATPと競合すると予想されます。 それでも他の化合物はアロステリックサイトをターゲットとしている可能性があり、そのような場合は、ATPとは競合しないと考えられます。 化合物の作用メカニズム特性を評価すると、ATPの有無や基質タンパク質の増減が、テスト化合物の親和性に影響していないか確認できます。 このような研究は、分子レベルの構造活性相関(SAR)を理解する上で有用で、新しいファーマコフォア探索でキーとなります。
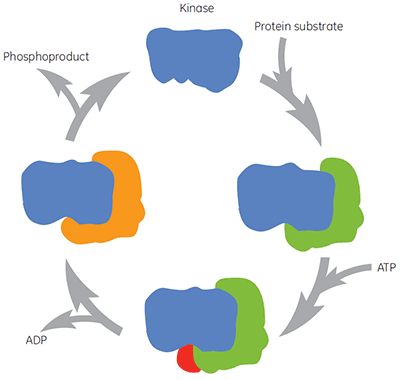
|
酵素反応アッセイは通常、反応経路に沿って生じる特定の酵素形態だけの状態にするようには設計されていません。 その結果、最大の親和性と関係のある酵素の形態の情報を直接入手することが難しい場合もあります。 ITCは酵素の形態を予め決定して異なる結合親和性を測定することで、この制約をクリアすることができます。 フリーの酵素に対する結合をみるのが最もシンプルなアプローチですが、ITCは反応機構によって生じるほかの酵素-基質タンパク質、酵素-ATP、酵素-ADP、酵素-リン酸化性生物複合体などのような酵素の形態を調べるように条件を調整できます。 また、非加水分解性のATPアナログを用いて基質とATP、両方をもつ酵素の三成分複合体に結合する可能性のある化合物を調べることができます。
プロテインキナーゼに対するテスト化合物の結合に与えるATPの影響を調べる実験を行いました。 100 µM ATP(ATPの一般的なKDの約60倍)が存在する場合と存在しない場合を対象に、テスト化合物に対してマルバーンMicroCal™ VP-ITCで測定を行いました。
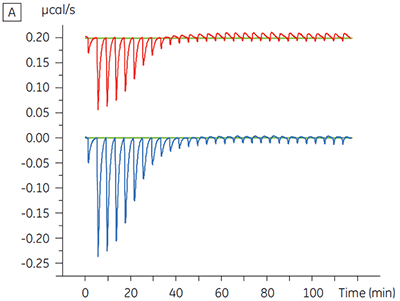
|
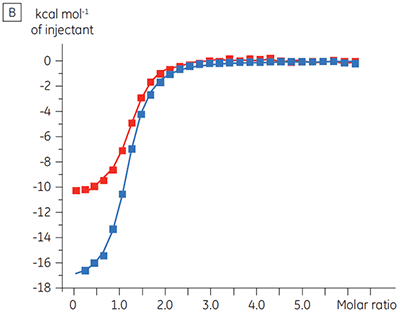
|
ITCの結果から、ATPの有無に関わらずテスト化合物のキナーゼに対する親和性は変わらないことが明らかになりました。 エンタルピー変化から、ATPの有無は親和性には影響しないことが示されましたが、結合のエンタルピー変化に大きな影響を与えることがわかりました。 これらの結果から、ATP結合に対してテスト化合物は非拮抗阻害しており、ATP存在下では結合様式になんらかの変化が起きていることが示唆されました。 ここで強調したいことは、ITCは化合物結合の詳細なメカニズムを評価する上で役立つだけでなく、親和性と結合エンタルピーの2つの重要な特性を一度に評価できる手法であるということです。 同様の実験では、同一のプロテインキナーゼに結合している別のテスト化合物で、ATPに対して不拮抗阻害が確認されました。 ATPが非存在下のKDは> 50 µM(標準的なITC実行では測定不可能)、ATP存在下では0.7 µMでした(図4)。
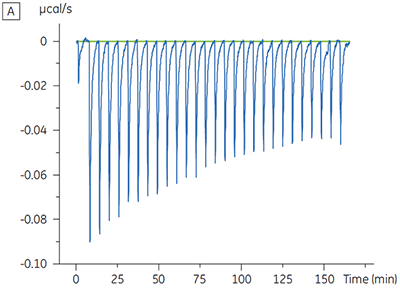
|
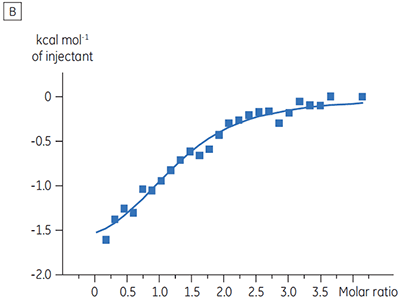
|
また別の例では、個別のタンパク質複合体への結合をダイレクトにモニターできることの利点も明らかになりました。この例では、1つのシグナル経路における連続した2つのキナーゼの複合体に対して、化合物の高い親和性結合があると考えられました。 ITCを使用すると、上流のキナーゼはもちろん、上流と下流のキナーゼの複合体に対しても(この複合体が実際に形成されたことが最初に示された後で)、化合物の結合を測定できます。 キナーゼ複合体に結合している化合物では、親和性が5倍に上昇していることが明らかになりました(図5)。
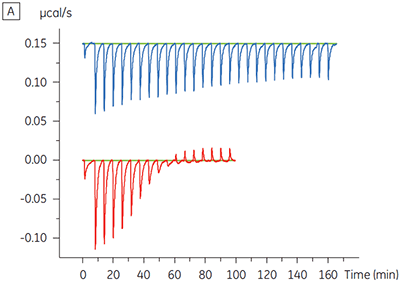
|
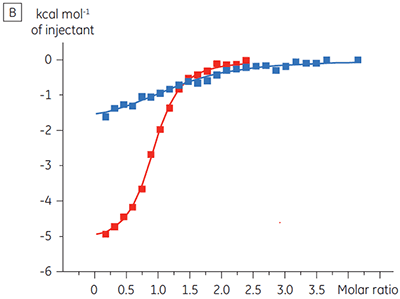
|
カロリメトリーの手法は、プロテインキナーゼ阻害剤の研究に有用な情報をもたらすことがわかりました。 また、ターゲットタンパク質の品質管理や、阻害剤結合のメカニズムについての詳細な分析と理解に役立ちます。
ハイスループットかつ全自動を実現したマルバーンのMicroCal Auto-iTC200やMicroCal VP-Capillary DSCは、これらの用途の価値を高めました。 さらにシステムはより少量のサンプル使用で済む方向に進んでおり、カロリメトリーの手法はこれからもラショナルドラッグデザインのプロセスに深く根付いていくでしょう。
Global Compound Sciences、Lead Generation- Discovery Capabilities & Sciences、Astra Zeneca Pharmaceuticals(Mereside, Alderley Park, Macclesfield, SK10 4TG, UK)の主任科学者、Geoff Holdgate