示差掃描量熱法 (DSC)
值得信賴的蛋白穩定性特性分析法

值得信賴的蛋白穩定性特性分析法

示差掃描量熱法 (DSC) 是一種分析技術,可用來直接分析蛋白或其他生物分子在其原始狀態下的穩定性。其運作方式為測量與分子以固定速度加熱時與熱變性相關的熱變化。
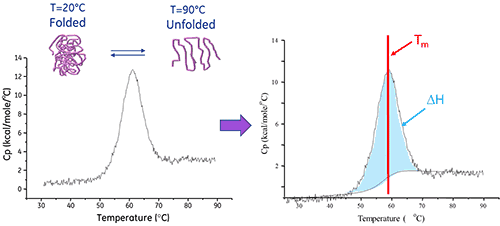
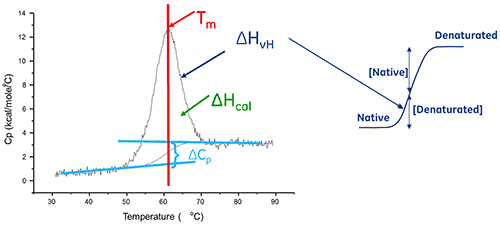
溶液中的生物分子會在其原始 (摺疊) 與變性 (展開) 構形之間達成平衡。熱轉變中點 (Tm) 越高,分子越穩定。DSC 測量熱引發變性所導致之展開的焓(∆H)。它也可以用來判定變性的熱容變化 (ΔCp)。DSC 可以釐清促成原始生物分子之摺疊與穩定性的各項因素。這些因素包括斥水性交互作用、氫鍵結、構形熵和物理環境。
DSC 所提供的準確且高品質資料,可用以深入瞭解製程開發及潛在候選藥物調配過程中的蛋白穩定性。
巨分子和巨分子集合體 (>5000 道耳頓) 如蛋白、核酸和脂質可形成完整分明的結構,這些結構會因熱而產生構形變化。這些結構重組會吸收由非共價鍵重新分佈所產生的熱。示差掃描熱分析儀可以測量此熱吸收。
DSC 系統的熱分析核心係由參考槽與樣本槽此二槽所組成。
裝置經特殊設計,可讓這兩個槽在受到加熱時彼此維持在相同的溫度。
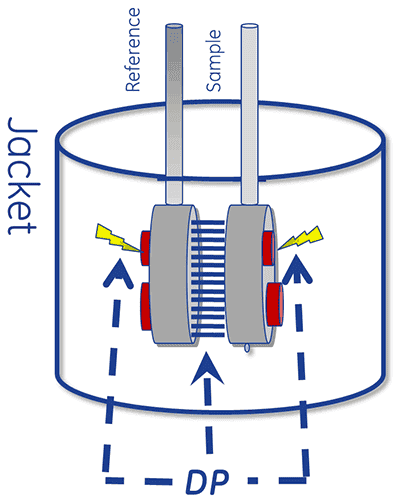
執行 DSC 測量時,首先在參考槽中填充緩衝液,並在樣本槽中填充樣本溶液。接著,在固定掃描速率下將這兩個槽加熱。
蛋白展開時發生的熱吸收會使這兩個槽之間出現溫度差 (ΔT),並使帕耳帖模組的兩端產生熱梯度。這會產生電壓,而此電壓會轉換為功率,用以控制帕耳帖模組,使 ΔT (溫度差) 回歸到 0°C。或者,也可讓這兩個槽透過傳導被動達成熱平衡。
蛋白展開的焓是濃度標準化 DSC 峰值下的面積且單位為卡 (或焦耳)/莫耳。
在某些情況下,可將熱力學模型對數據進行擬合以獲得吉布氏自由能 (ΔG)、量熱焓 (ΔHcal)、凡特何夫焓 (ΔHvH)、熵 (ΔS) 和與該轉變相關的熱容變化 (ΔCp)。
示差掃描量熱法分析廣泛用於 藥物探索與開發。關鍵應用包括:

PEAQ-DSC Automated受規範環境蛋白質穩定性分析的黃金標準 |

PEAQ-DSC蛋白質穩定性分析研究和應用的黃金標準 |
|
|---|---|---|
| 量測類型 | ||
| 免標定分析 | ||
| 蛋白質穩定性 | ||
| 技術類型 | ||
| 差示扫描量热法 (DSC) | ||
| 通量 | ||
| 温度范围 | ||