
IVBE (In Vitro Bioequivalence, Bioequivalência in vitro)
Soluções de caracterização físico-química para garantir a equivalência microestrutural Q3

Soluções de caracterização físico-química para garantir a equivalência microestrutural Q3

A crescente complexidade das formulações de medicamentos está impulsionando a aplicação de testes de bioequivalência in vitro (IVBE) — o processo de utilização de técnicas in vitro para avaliar a biodisponibilidade e a bioequivalência de um produto de teste com o produto RLD (Reference Listed Drug, Medicamento de referência listado) — para ajudar a otimizar e acelerar o desenvolvimento de medicamentos. Subjacente a essa tendência está o reconhecimento da importância da microestrutura de formulação no controle do fornecimento e da liberação de medicamentos.
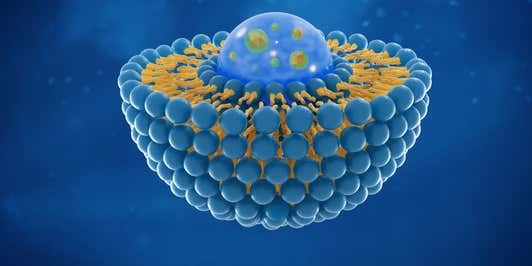
Uma série de propriedades físico-químicas são fundamentais para entender a microestrutura de uma formulação farmacêutica. Isso inclui distribuição e tamanho de glóbulos e partículas, carga de partículas, forma polimórfica, comportamento de fase, morfologia de partículas e estrutura molecular. A caracterização, o controle e a otimização desses parâmetros estimulam o sucesso do desenvolvimento, permitindo uma compreensão detalhada de como a estrutura e as propriedades da formulação afetam o processamento e o desempenho do produto medicamentoso.
O kit de ferramentas da Malvern Panalytical de técnicas e experiência em análise físico-química permite a avaliação das propriedades de APIs, excipientes e formulações de produtos farmacêuticos. Esse kit de ferramentas inclui soluções para análise de composição, caracterização morfológica e determinação da estrutura e interação entre os componentes. Todos têm um papel crítico, não apenas na capacitação de estudos bem-sucedidos de IVBE, mas também na obtenção da compreensão essencial da estabilidade e do desempenho de uma formulação que fornece a base para uma otimização mais focada.
Alcançar a entrega de medicamentos reproduzíveis é um desafio significativo, pois formulações cada vez mais complexas são aplicadas para lidar com desafios como baixa solubilidade de API, liberação modificada e requisitos de entrega localizados ou direcionados. Produtos medicamentosos complexos podem ser definidos como aqueles que envolvem um ou mais dos seguintes:
A análise físico-química apoia o desenvolvimento de formulações complexas através da elucidação da microestrutura do medicamento, do excipiente e da formulação. Isso proporciona aos desenvolvedores a percepção necessária in vitro, durante o desenvolvimento e a otimização da formulação, para atingir a biodisponibilidade necessária in vivo. A análise microestrutural também ajuda na produção comercial, garantindo que os atributos essenciais do material que afetam o desempenho e a estabilidade da formulação sejam monitorados e controlados.
A Malvern Panalytical oferece uma ampla gama de ferramentas de análise microestrutural e experiência essencial para o desenvolvimento de formulações complexas. Essas ferramentas fornecem o conhecimento necessário para mitigar o risco de decisões de formulação e para acelerar o desenvolvimento bem-sucedido da formulação.





A aplicação de abordagens de bioequivalência in vitro é reconhecida pelos reguladores como um importante capacitador para o desenvolvimento eficaz de formulações de medicamentos genéricos complexos. O FDA dos EUA e outros reguladores emitiram orientações específicas para o produto que destacam o papel de avaliar a equivalência físico-química (Q3) como parte do estabelecimento da bioequivalência de um produto genérico de teste com um produto de RLD (Reference Listed Drug, Medicamento de referência listado). Ao eliminar a necessidade de estudos clínicos de endpoint, essa abordagem pode reduzir significativamente o tempo de lançamento no mercado de novos genéricos.
O conjunto de ferramentas de caracterização físico-química da Malvern Panalytical oferece as técnicas analíticas avançadas e a experiência necessárias para dar suporte a estudos essenciais de bioequivalência. Ele também oferece capacidade além dos requisitos normativos básicos, fornecendo análises físico-químicas direcionadas que permitem uma maior compreensão da composição, do comportamento e da estabilidade de uma formulação. Essa exploração e percepção no espaço de design da formulação ajudam a simplificar a otimização da formulação do protótipo, reduzindo o número de experimentos necessários para alcançar a formulação ideal e reduzindo o risco de falhas durante a expansão.





Durante a fase comercial do ciclo de vida de um medicamento, pode haver um requisito para modificar seu processo de fabricação. Isso pode, por exemplo, ser uma resposta a mudanças na fonte de matérias-primas ou intermediários críticos. Como alternativa, pode haver a necessidade de mover a fabricação para outra instalação, ou possivelmente terceirizar um parceiro, em resposta às mudanças na demanda de um determinado produto medicamentoso. Manter a aprovação regulamentar do produto nessas situações requer a identificação dos elementos de fabricação e formulação que devem ser mantidos para garantir a qualidade do produto.
A aplicação de técnicas de bioequivalência in vitro proporciona uma abordagem realista e baseada na ciência para identificar os atributos materiais críticos associados à formulação de um medicamento, permitindo a definição de uma estratégia de controle para gerenciar as alterações pós-aprovação. As ferramentas de caracterização físico-química da Malvern Panalytical, juntamente com nosso conhecimento e experiência dos requisitos para validação e transferência de métodos, podem ajudá-lo a definir uma estratégia analítica adequada para apoiar o gerenciamento de alterações, garantindo que o desempenho e a segurança do produto sejam mantidos.
Os serviços do Amplify Analytics estão disponíveis para ajudar nossos clientes com seus desafios de caracterização físico-química e o desenvolvimento, a validação e a implantação de métodos analíticos para apoiar a formulação e a fabricação de produtos farmacêuticos.