Calorimetría de barrido diferencial (DSC)
Caracterización confiable de la estabilidad de las proteínas

Caracterización confiable de la estabilidad de las proteínas

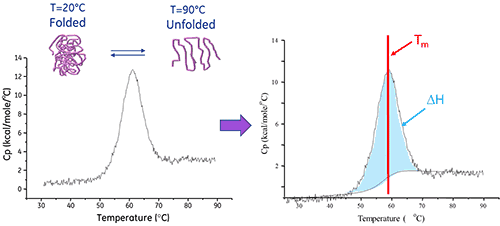
La calorimetría de barrido diferencial (DSC) es una técnica de análisis que se usa para caracterizar la estabilidad de una proteína u otra biomolécula directamente en su forma nativa. Lo hace mediante la medición del cambio de calor asociado con la desnaturalización térmica de la molécula cuando se calienta a un ritmo constante.
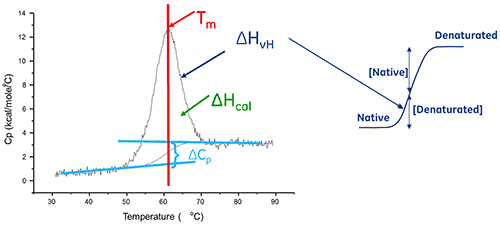
Una biomolécula en solución está en equilibrio entre sus conformaciones nativa (plegada) y desnaturalizada (desplegada). Cuanto mayor es el punto medio de transición térmica (Tm), más estable es la molécula. La DSC mide la entalpía (∆H) de despliegue que resulta de la desnaturalización inducida por calor. También se utiliza para determinar el cambio en la capacidad de calor (ΔCp) de la desnaturalización. La DSC puede dilucidar los factores que contribuyen al plegado y la estabilidad de las biomoléculas nativas. Estos factores incluyen interacciones hidrofóbicas, enlaces de hidrógeno, entropía de conformación y ambiente físico.
Los datos precisos y de alta calidad obtenidos a partir de DSC proporcionan información vital sobre la estabilidad de proteínas en el desarrollo de procesos y en la formulación de posibles candidatos terapéuticos.
Las macromoléculas y conjuntos macromoleculares (>5000 daltons) como proteínas, ácidos nucleicos y lípidos pueden formar estructuras bien definidas que se someten a cambios de conformación térmicamente inducidos. Estos rearreglos estructurales dan lugar a la absorción de calor causada por la redistribución de enlaces no covalentes. Los calorímetros de barrido diferencial miden esta absorción de calor.
El núcleo térmico de un sistema DSC se compone de dos celdas, una de referencia y otra de muestra.
El dispositivo está diseñado para mantener las dos celdas a la misma temperatura a medida que se calientan.
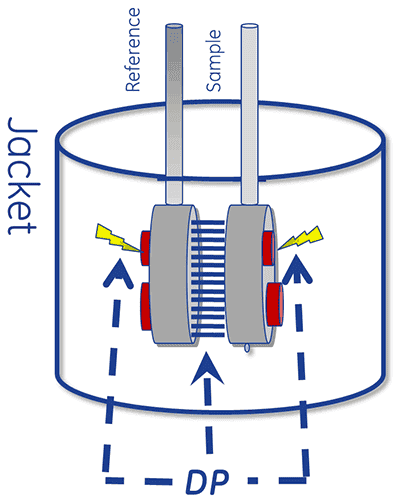
Para realizar una medición de DSC, la celda de referencia se llena primero con solución reguladora y la celda de muestra con solución de muestra. Luego, se calientan con un incremento de barrido constante.
La absorción de calor que se produce cuando una proteína se despliega provoca una diferencia de temperatura (ΔT) entre las celdas, lo que da como resultado un gradiente térmico a lo largo de las unidades de Peltier. Esto configura una tensión, que se convierte en energía y se utiliza para controlar el Peltier para devolver el ΔT (el diferencial de la temperatura) a 0 °C. Alternativamente, se puede permitir que las celdas alcancen el equilibrio térmico pasivamente a través de la conducción.
La entalpía de despliegue de proteínas es el área bajo el pico de DSC normalizado en función de la concentración, y sus unidades son calorías (o joules) por mol.
En ciertos casos, se pueden ajustar modelos termodinámicos a los datos para obtener la energía libre de Gibb (ΔGcal), la entalpia calorimétrica (ΔHcal), la entalpia de van't Hoff (ΔHvH), la entropía (ΔS) y el cambio en la capacidad de calor (ΔCp) asociado con la transición.
El análisis de calorimetría de barrido diferencial es ampliamente utilizado para el descubrimiento y desarrollo de fármacos. Las aplicaciones clave incluyen las siguientes:

PEAQ-DSC automatizadoAnálisis de referencia de estabilidad de proteínas para un ambiente regulado |

PEAQ-DSCAnálisis de referencia de estabilidad de proteínas para aplicaciones de investigación |
|
|---|---|---|
| Tipo de medición | ||
| Análisis libre de etiquetas | ||
| Estabilidad de proteínas | ||
| Tecnología | ||
| Calorimetría de barrido diferencial (DSC) | ||
| Rendimiento de muestra | ||
| Rango de temperatura | ||