ウイルスの開発と生産では、プロセスのさまざまな段階でのウイルス濃度を確認し、使用するクローンと生産収率を最適化することが重要です。 たとえば、クローンスクリーニング、感染多重度(MOI)の最適化、細胞培養法の適応などのインスタンスは、ウイルス濃度、つまり、通称ウイルス力価に関心がある場合です。
動的光散乱(DLS)は、ウイルスの開発、スクリーニング機能でよく使用され、汚染物質や凝集体を含むサンプルから良好で安定したサンプルを分離します。 Zetasizer Ultraで新しい多角度DLS (MADLS)ベースの粒子濃度測定を使用して、粒子径と粒子径分布、および母集団ごとの粒子濃度を数分以内に取得できるようになりました。
このアプリケーションノートでは、AllerganがZetasizer Ultraの評価から得たデータを快く共有しており、アデノ随伴ウイルス(AAV)のサンプルの例が3つ示されています。 濃度の結果は、カプシドELISAベースのウイルス力価アッセイの結果と比較しています。
ウイルスの開発と生産では、使用するクローンだけでなく,生産収率を最適化するために,プロセスのさまざまな段階でのウイルス濃度を把握することが重要です。 たとえば、クローンスクリーニング、感染多重度(MOI)の最適化、細胞培養法への適応などの実証は、ウイルス濃度、通称ウイルス力価に関連しています。
動的光散乱(DLS)
は、ウイルス開発で使用する原薬を測定したり、スクリーニングで使用してコンタミや凝集体を含むサンプルと分散が安定しているサンプルを区別することができます。
Zetasizer Ultra
では,新しい多角度DLS(MADLS)による粒子濃度測定を使用して、粒子径と粒子径分布、および母集団ごとの粒子濃度を数分以内に取得できるようになりました。
このアプリケーションノートでは、AllerganがZetasizer Ultraの評価から得たデータを快く共有しており、アデノ随伴ウイルス(AAV)のサンプルの例が3つ示されています。 濃度の結果は、カプシドELISAベースのウイルス力価アッセイの結果と比較しています。
サンプルは、少量の石英キュベット(ZEN2112)を使用して測定しました。 測定は、Zetasizer UltraでMADLS(粒子濃度測定)を使用して実行しました。これにより、MADLSによる粒子径分布と各ピークの濃度の両方の情報が得られます。 この測定を使用する場合は、以下のパラメータをユーザが提供する必要があります。
粒子情報: ウイルスのカプシドはタンパク質の殻でできているため、測定はタンパク質の屈折率を使用して実行しました。
分散媒情報: 分散媒は当初水に設定していましたが、後で粘度を補正し、粒子濃度の結果を編集して正しい粒子径と濃度を取得しました。 粒子濃度の計算には、測定された粒子径の精度が非常に重要になりますす。 緩衝液の粘度は、ビーズレーシング[1]を使用して測定しました。この場合、60~200 nmのポリスチレンラテックスビーズの使用をお勧めします。 ビーズの粒子径が大きくなるほど散乱光が多くなるため、サンプルにビーズを多くを加える必要がありません。
緩衝液の散乱光量測定(後方散乱角度): 緩衝液の散乱光強度は、後方散乱角度を使用して単一の角度測定を設定し、測定位置をキュベットの中心に設定し、測定に使用したのと同じキュベット(ZEN2112)で測定しました。 通常の測定として実行すると、導出された散乱光量が粒子濃度測定の[緩衝液の散乱光量を入力]フィールドで使用できます。
3回の繰り返し測定の実行時間は4分未満です。
3つのAAVサンプルの散乱光強度による粒子径分布を図1のグラフA~Cに示します。 対応する粒子濃度を図2のグラフC〜Fに示します。 図1のグラフAに示すATCC AAV2referenceサンプルには、凝集体が含まれていますが、これは驚くことではありません。このサンプルは凍結状態から解凍されたもので、利用可能な量が少ないため、事前濾過せずにキュベットに直接挿入されたものです。 凝集体の存在にもかかわらず、MADLSベースの粒子濃度は、カプシドELISAアッセイ(0.92 x 1012 粒子数/ml)と十分に相関する濃度値(1.12 x 1012 粒子数/ml)を示しています。 凝集体濃度の詳細については、表1を参照してください。 Allerganの2つのAAVサンプルでは、検出される凝集体が非常に少ないかゼロであり、表1からわかるように、両方のサンプルに関するウイルスピークの濃度値はカプシドELISAの結果と十分に相関しています。
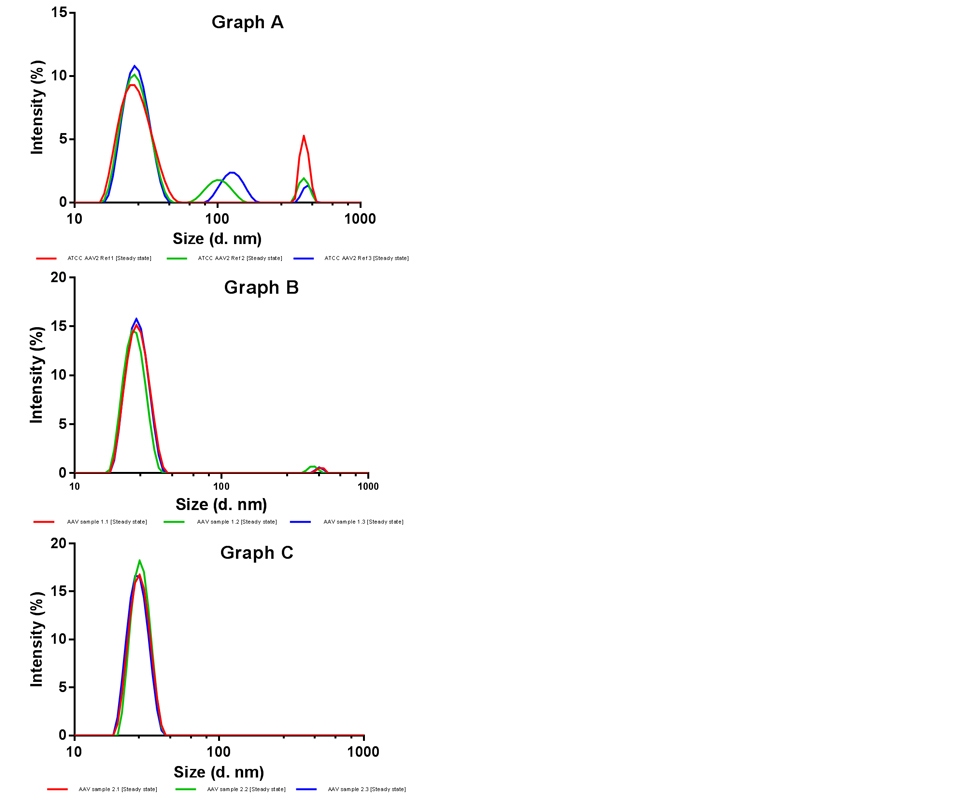
図1: 3つの各サンプルごとに3回の繰り返し測定を示します: グラフA - ATCC AAV2referenceサンプル、グラフB - Allergan AAVサンプル1、グラフC - Allergan AAVサンプル2。
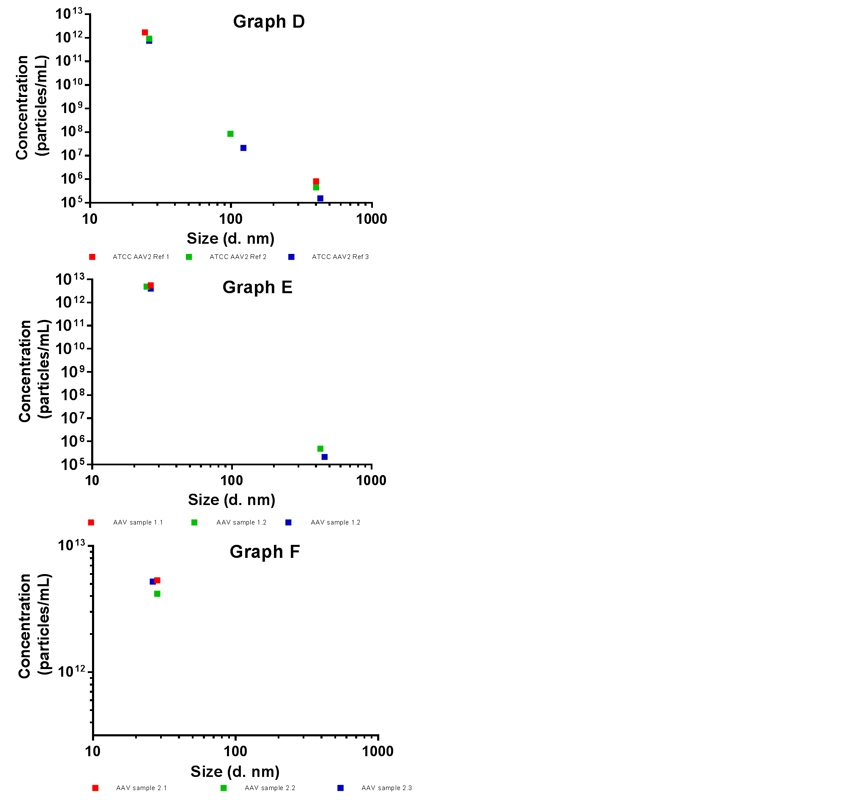
図2: 図1と同じ3つのサンプルに関する3回の繰り返し測定の分布粒子濃度: グラフC- ATCC AAV2referenceサンプル、グラフE - Allergan AAVサンプル1、グラフF - Allergan AAVサンプル2。
ばらつきを比較するために、%CVを計算しました。各繰り返し測定の濃度結果を取得し、標準偏差と平均値を計算して、これから%CVを計算しました。
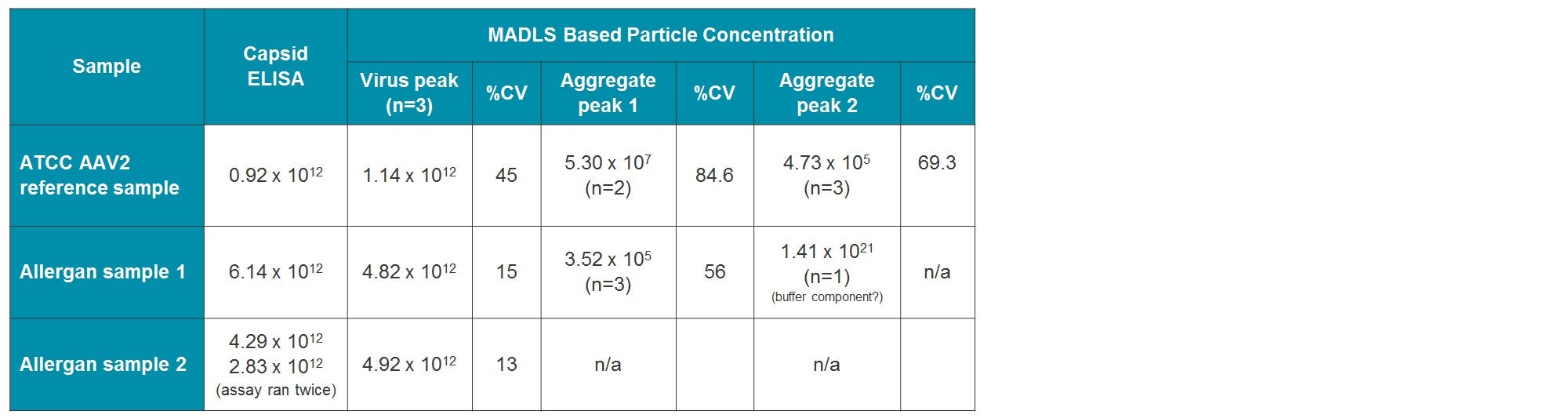
表1 3つのサンプル(ATCC AAV2参照サンプル、Allerganサンプル1、Allerganサンプル2)に関するカプシドELISAアッセイからの濃度データとMADLSベースの粒子濃度の結果。 すべての濃度は粒子数/mlで表示されます。 n=iは、3回の繰り返し測定のうち、ピークが識別された回数を示します。 母集団のピークが存在しない場合は、該当なしとしてn/aが表示されます。
表1の結果を比較すると、ATCC AAV2referenceサンプルがウイルス濃度測定の繰り返し安定性値の最大%CVを示しました。 これはサンプルの凝集体による影響で、AAVピークをどの程度適切に決定できるかに影響を与えます。 図1Aの粒子径ピークの再現性を図1Bまたは1Cの他のウイルスのピークのいずれかと比較すると、後者のオーバーレイの方が適切で再現性が高いことがわかります。 これは濃度測定の再現性に直接影響します。 Allerganの2つのAAVサンプルは、サンプルに凝集体がないかいくつか存在する場合、約15%のピーク再現性を示しました。
提示されたデータは、Zetasizer UltraのMADLSベースの粒子濃度がAAVウイルスサンプルの粒子径分布を提供でき、そのためにサンプルの凝集状態に関するレポートを提供でき、メインウイルスの濃度と存在する凝集体に関する情報を提供できることを示しています。 各繰り返し測定にかかる時間は4分未満です。
キュベット内の測定全体にわたってサンプルを密閉しておくことができるため、汚染のリスクが最小限に抑えられ、オペレータへの曝露リスクが最小限に抑えられます。
最後の注記として、テスト中に、粒子濃度の最も正確な測定を確保するために、正しいサンプル粘度を使用するのが重要であることが確認されました。 分散媒の粘度を測定するには、粘度計を使用するか、Zetasizer Ultra装置自体で粒子径referenceビーズを使用します[1]。
[1] Determining Dispersant Viscosity Using Dynamic Light Scattering; Malvern Panalytical Application Note