

Physikochemische Analyselösungen und Fachwissen für die leichtere Entwicklung von Arzneimittelformulierungen, abgestimmt auf die Anforderungen an Bioverfügbarkeit und Verarbeitung
Die Entwicklung pharmazeutischer Formulierungen ist das Bindeglied zwischen der Entdeckung eines neuen Wirkstoffs und der erfolgreichen Umsetzung in ein kommerzielles Arzneimittelprodukt. Wissenschaftler in der Formulierungsentwicklung müssen den optimalen Ansatz zur effektiven Verabreichung des Medikaments basierend auf den Bedürfnissen des Patienten finden. Anschließend gilt es die Eigenschaften der Formulierung basierend auf den Kenntnissen über Bioverfügbarkeit und Verarbeitungsanforderungen des Arzneimittels zu optimieren.
Diese Aufgabe stellt eine Herausforderung dar. Nur 10 % der neuen Arzneimittel in der präklinischen Formulierungsentwicklung erreichen erfolgreich den Markt. Da die Kosten für die pharmazeutische Entwicklung steigen und der Druck, den Wert der Medikamentenpipeline zu steigern, ebenfalls zunimmt, wenden innovative Unternehmen, die Medikamente entwickeln, viel Mühe auf, um die effektive Formulierungsauswahl zu beschleunigen. Die Entwicklung eines umfassenden Verständnisses der Form und der Struktur des Wirkstoffs und des Arzneimittelprodukts wird dabei als ein Schlüssel zum Erfolg angesehen.
Ähnliche Herausforderungen bestehen für Unternehmen der generischen Pharmazie, wo die erfolgreiche Entwicklung komplexer Arzneimittelformulierungen weiterhin schwierig ist. Es gibt einen bedeutenden und bisher ungenutzten Markt für neue komplexe Generika. Von den globalen Aufsichtsbehörden angeleitet, wird nun erkannt, dass ein detailliertes physikochemisches Verständnis der Mikrostruktur komplexer Darreichungsformen eine erfolgreiche Produktentwicklung ermöglichen kann.
Die physikochemischen Verfahren von Malvern Panalytical werden routinemäßig eingesetzt, um diese Herausforderungen bei der Formulierung anzugehen. Unsere Lösungen werden zur Charakterisierung der physikochemischen Eigenschaften und zum besseren Verständnis der Arzneimittelsubstanz und der Produktform verwendet , um die Auswahl von Trägerstoffen zu erleichtern und die Funktion von Trägerstoffen innerhalb von Formulierungen zu verstehen, und um zu beurteilen, wie sich Lagerung oder Verarbeitung auf die Leistung des Arzneimittels auswirken können.Unser Fachwissen ermöglicht die Bereitstellung der richtigen Daten und liefert Erkenntnisse, die den Erfolg der Formulierungsentwicklung fördern.






Die Entwicklung einer erfolgreichen pharmazeutischen Formulierung erfordert die Kombination eines aktiven pharmazeutischen Wirkstoffs (API) mit inaktiven Trägerstoffen. Bei den Trägerstoffen kann es sich um einfache Füllstoffe handeln, die zur Kontrolle der Gleichmäßigkeit des Dosisgehalts dienen. Einige Trägerstoffe spielen jedoch zunehmend eine funktionale Rolle bei der Steuerung der Wirkstofffreisetzung oder der Sicherstellung, dass der Wirkstoff den gewünschten Wirkort erreicht. Hier ist die Kompatibilität zwischen dem ausgewählten Trägerstoff und der Wirkstoffsubstanz entscheidend, um sicherzustellen, dass die richtige Dosis innerhalb des erforderlichen therapeutischen Fensters abgegeben wird. Die physikochemische Analyse kann bei der Auswahl des Trägerstoffs unterstützen, die Beurteilung der Stabilität des Wirkstoffs und des Arzneimittelprodukts ermöglichen und auch sicherstellen, dass die kritischen Materialeigenschaften als Teil der Definition des Designraums für die nachgeschalteten Herstellungskontrollen bestimmt werden.
Der Zetasizer Ultra kann zur Charakterisierung der Stabilität und Qualität von Dispersionen, Emulsionen und Cremes verwendet werden. Dadurch wird die Rezepturentwicklung verkürzt, sodass neue Produkte schneller zur Marktreife gelangen.
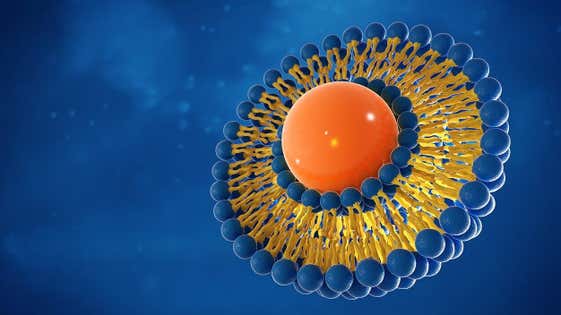
Die immer komplexer werdenden Anforderungen an die reproduzierbare Wirkstoffabgabe stellen eine alltägliche Herausforderung für Wissenschaftler in der Formulierungsentwicklung dar. Viele neue aktive pharmazeutische Wirkstoffe (APIs) sind schlecht löslich, was bedeutet, dass die herkömmliche orale Verabreichung in fester Form nicht mehr relevant ist. Die Formulierungskomplexität nimmt daher zu, entweder um die Bioverfügbarkeit für die orale Verabreichung zu erhöhen oder um eine lokale Verabreichung zu ermöglichen, damit die Wirkstoffkonzentration am Wirkort den therapeutischen Anforderungen entspricht.
Neuartige Arzneimittelverabreichungssysteme, die auf Liposomen oder anderen Nanopartikel-Verabreichungssystemen basieren, werden immer häufiger eingesetzt, um die Zielgenauigkeit von Arzneimitteln zu verbessern. Das Angebot an ergänzenden Analysemethoden von Malvern Panalytical ermöglicht es Formulierungsentwicklern, die Formulierung und Stabilität von aktiven pharmazeutischen Wirkstoffen (API) und Trägerstoffen zu verstehen. Dies hilft bei der Optimierung komplexer Formulierungen und spart Zeit bei der Auswahl einer wirksamen Ansatzformulierung.
Die Herausforderungen bei der Entwicklung komplexer Formulierungen erstrecken sich auch auf die Entwicklung generischer Arzneimittel. Aufsichtsbehörden auf der ganzen Welt haben die Auswirkungen eines Mangels an erfolgreichen Einführungen komplexer Generika auf die die Kosten im Gesundheitswesen erkannt. Als Reaktion darauf haben sie einen produktspezifischen Leitfaden herausgegeben, in dem die Rolle der Beurteilung der physikochemischen oder Q3-Äquivalenz als Teil der Bewertung der Bioäquivalenz eines generischen Testprodukts im Vergleich zu einem Produkt der Referenzliste (RLD) hervorgehoben wird.
Die Anwendung eines Ansatzes für In-vitro-Bioäquivalenzprüfungen hat das Potenzial, die Zeit bis zur Markteinführung neuer Generika erheblich zu verkürzen, da keine klinischen Endpunktstudien erforderlich sind. Die Produktpalette von Malvern Panalytical für physikochemische Analyseverfahren und das Fachwissen, die die Beurteilung der Eigenschaften des Arzneimittels und der Arzneimittelformulierung ermöglichen, spielen eine entscheidende Rolle für erfolgreiche In-vitro-Bioäquivalenzuntersuchungen.

Die Entwicklung eines erfolgreichen Generikums beginnt mit dem Verständnis der Struktur und der Wirkung des Referenzmedikaments (Reference Listed Drug, RLD). Hier, wie auch bei In-vitro-Bioäquivalenzbewertungen, spielt die physikochemische Analyse eine wichtige Rolle, um das Verständnis der Anforderungen an pharmazeutische Formulierungen voranzutreiben. Eine proaktive, quantitative, strukturelle und morphologische Charakterisierung des Wirkstoffs und der Trägerstoffe, die im RLD-Produkt vorhanden sind, kann eine Optimierung der Prototyp-Formulierung ermöglichen und die Entwicklungsrisiken erheblich verringern.
Die Vorteile dieses Deformulierungsansatzes sind nicht auf Generika-Unternehmen beschränkt. Ähnliche Methoden werden auch bei der Entwicklung und Herstellung neuer Arzneimittel angewendet, um die Ursache für Veränderungen der Leistungsmerkmale einer Formulierung während der Skalierung zu ermitteln. Es kann Unternehmen auch dabei helfen, Auswirkungen von Änderungen im Herstellungsprozess oder am Herstellungsort nach der Markteinführung auf die Leistung eines Arzneimittels zu verstehen.
Das Morphologi 4-ID kann verwendet werden, um Herausforderungen der Deformulierung zu vereinfachen und zu lösen, sowie die In-vitro-Bioäquivalenz zu ermitteln. Es können aber auch Kontaminanten erkannt und Prozessabweichungen während der Herstellung genau bestimmt werden.