
Rango de equipos MicroCal ITC
Determina los parámetros de enlace de las biomoléculas en un solo análisis
Medición sin marcadores de la afinidad de enlace y la termodinámica de las interacciones biomoleculares para entender la función y los mecanismos a nivel molecular
La calorimetría de titulación isotérmica (ITC, del inglés Isothermal Titration Calorimetry) es una técnica de cuantificación sin etiquetas que se utiliza en estudios de una amplia variedad de interacciones biomoleculares. Funciona mediante la medición directa del calor que se libera o absorbe durante un evento de enlace biomolecular.

Determina los parámetros de enlace de las biomoléculas en un solo análisis
ITC es la única técnica que puede determinar simultáneamente todos los parámetros de enlace en un solo experimento. Sin necesidad de modificar los componentes del enlace, ya sea con marcadores fluorescentes o por medio de inmovilización, ITC mide la afinidad de los componentes del enlace en sus estados nativos.
La medición de la transferencia de calor durante el enlace permite la determinación exacta de las constantes de enlace (KD), la estequiometría de la reacción (n), la entalpía (∆H) y la entropía (∆S). Esto proporciona un perfil termodinámico completo de la interacción molecular. ITC va más allá de las afinidades de enlace y puede dilucidar los mecanismos subyacentes en las interacciones moleculares. Esta comprensión más profunda de las relaciones entre estructura y función permite que se tomen decisiones más confiables para la selección y optimización de componentes prometedores.
La calorimetría de titulación isotérmica se utiliza para medir las reacciones entre biomoléculas. La metodología permite la determinación de la afinidad de enlace, la estequiometría y la entropía y entalpía de la reacción de enlace en la solución, sin la necesidad de utilizar etiquetas.
Cuando se produce el enlace, el calor se absorbe o se libera, y esto se mide con un calorímetro sensible durante la titulación gradual del ligando en la celda de la muestra que contiene la biomolécula de interés.

En el microcalorímetro hay dos celdas, una de las cuales contiene agua y actúa como celda de referencia, y otra que contiene la muestra. El microcalorímetro necesita mantener estas dos celdas exactamente a la misma temperatura. Los dispositivos de detección de calor detectan la diferencia de temperatura entre las celdas cuando se produce el enlace y retroalimentan a los calentadores, que compensan esta diferencia y devuelven las celdas a la misma temperatura.
La celda de referencia y la celda de la muestra se ajustan a la temperatura experimental deseada. El ligando se carga en una jeringa, que se encuentra en un dispositivo de inyección muy preciso. El dispositivo de inyección se inserta en la celda de la muestra que contiene la proteína de interés. Una serie de pequeñas alícuotas de ligando se inyecta en la solución de proteínas. Si hay un enlace del ligando a la proteína, se detectan y se miden los cambios de calor de unas pocas millonésimas de grado centígrado.
Cuando se hace la primera inyección, el microcalorímetro mide todo el calor liberado hasta que la reacción de enlace alcanza el equilibrio. La cantidad de calor medida es directamente proporcional a la cantidad de enlace.
En el ejemplo siguiente, la reacción es exotérmica, lo que significa que la celda de la muestra se calienta más que la celda de referencia y provoca un pico hacia abajo en la señal. A medida que la temperatura de las dos celdas se iguala de nuevo, la señal vuelve a su posición inicial. La segunda alícuota pequeña del ligando se inyecta en la celda de la muestra y una vez más el microcalorímetro compensa el pequeño cambio de calor detectado.
La relación molar entre el ligando y la proteína se incrementa gradualmente mediante una serie de inyecciones de ligando. La proteína se satura cada vez más, se produce menos enlace del ligando y el cambio de calor comienza a disminuir hasta que en última instancia la celda de la muestra contiene un exceso de ligando en comparación con la proteína, con lo que la reacción alcanza el punto de saturación.

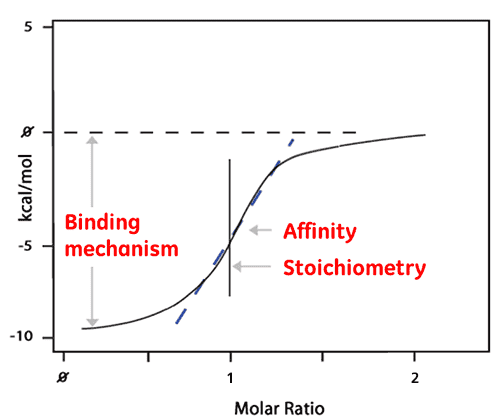
El área de cada pico se integra entonces y se grafica con respecto a la relación molar de ligando a proteína. La isoterma resultante puede ajustarse a un modelo de enlace del que se deriva la afinidad (KD). La relación molar en el centro de la isoterma de enlace nos da la estequiometría de la reacción. La gráfica que se muestra a continuación es un ejemplo de una reacción de enlace 1:1.
La entalpía (ΔH) también se deriva directamente de la isoterma y es la cantidad de calor liberado por mol del enlace de ligando. Esto significa que un solo experimento ITC ofrece una gran cantidad de información acerca de la reacción de enlace, lo que ayuda a comprender la naturaleza de la interacción y a explorar los factores termodinámicos.
ITC se utiliza ampliamente en las áreas de descubrimiento y desarrollo de medicamentos para:

PEAQ-ITCMedición de alta sensibilidad de todos los parámetros de enlace. |

MicroCal PEAQ-ITC automatizadoMedición de alta productividad de múltiples parámetros de enlace. |
|
|---|---|---|
| Tipo de medición | ||
| Análisis libre de etiquetas | ||
| Afinidad de unión | ||
| Tecnología | ||
| Calorimetría de titulación isotérmica (ITC) | ||
| Rendimiento de muestra | ||