本書では、複数のドメインを持つタンパク質の個別のドメインの安定性を評価し、抗体およびその他のタンパク質のプロセス開発のガイドを示すためにDSCがどのように使用されているかについて説明します。
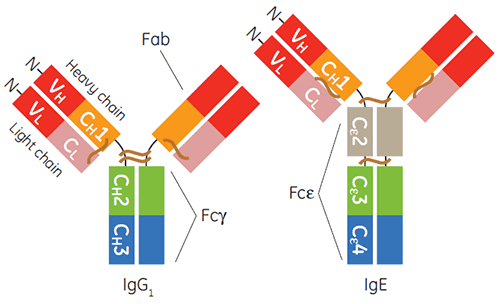
診断または治療用のガンマアイソタイプの免疫グロブリン、特にヒトIgG1の製造と精製は一般的に行われています。 この10年間では、IgEベースの治療法が本格化してきています。 IgEは宿主に対する宿主防衛や防御炎症にとって重要です。 ただし受容体を介したIgE起因のシグナルは、アレルギー炎症疾患の主だった要因でもあります。 IgEの定常部は、3つの特有のIg-フォールドドメイン(Cε2、Cε3、Cε4)のペアを含むホモ二量体で、2つの受容体(FcεRIとCD23。別名FcεRII)との結合部位となっています。
このアプリケーションノートでは、示差走査型カロリメトリー(DSC)を使用し、lgGとlgEのバイオ製剤開発プロセスを多角的に解釈する方法についてフォーカスします。 DSCを使用すると、標識やアーティファクトなプローブを使うことなくタンパク質のアンフォールディングを短時間で調べることができます。 DSCはサンプルが吸収した熱をタンパク質のアンフォールディングと判定します。これにより、熱安定性を測定し、長期安定性の指標を得ることができます。
ここで説明している取り組みでは、DSCを使用し、IgGおよびIgE薬品をどのように取り扱い、精製し、製剤するのかを知る上での手がかりとなります。 これらの知見に寄与する、円二色性スペクトル(CD)の情報とDSCで得られるものを比較しました。 DSCではマルチドメインタンパク質の個別ドメインレベルでタンパク質の安定性が評価できます。これはCDで得られるデータでは明らかにならないものです。
|
マルバーンMicroCal VP-Capillary DSCを使用して実験を行いました。
精製されたFcε、Fcγ、Fcγ-Cε2タンパク質は、既存の方法(5)で作製されました。 Capillary DSCの測定は、異なるpH条件で400回以上のスキャンをほとんど労力を要せずに、4ヶ月で実施しました。 タンパク質の濃度測定、希釈、プレートへのセットアップを含め、FcεおよびFcγ用の実験に要した時間はおよそ3時間でした。 その後の測定は、MicroCal VP-Capillary DSCの自動運転で実施されました。 詳細については、(5)を参照してください。
産業環境下における多くのアフィニティ精製プロセスのタンパク質にとって、広範囲のpHおよび塩に対する安定性は必須の前提条件です。 異常なpHまたは塩条件に対して耐性が低いと、タンパク質の凝集や機能を失ったタンパク質が生じることがあります。 さまざまなpH/塩条件に対するFcεの安定性は、IgE/Fcε含有タンパク質の適切な精製スキームを決定する上で重要な情報です。 Fcεの2次構造に対するpHの影響を確認するために、pH 4.5~7.4の緩衝液条件下でCDスペクトルを測定しました。
pH 5.2~7.4の間では、Fcεのスペクトルは一致していました。また、216~217 nmの1つの極小値が含まれており、これはß-sheetの存在を示し、典型的なIgドメインであることがわかりました。 pH 5では、Fcεスペクトルはランダムコイル方向にシフトしました(極小値が200 nmの方向にシフト)。pH 4.5では、スペクトルはタンパク質の大部分がランダムコイルであることを示しました(5)。 pH依存アンフォールディングの情報に基づいて、Fcεの安定性がpH 7.0~4.5で変化するかどうかを確認しました。
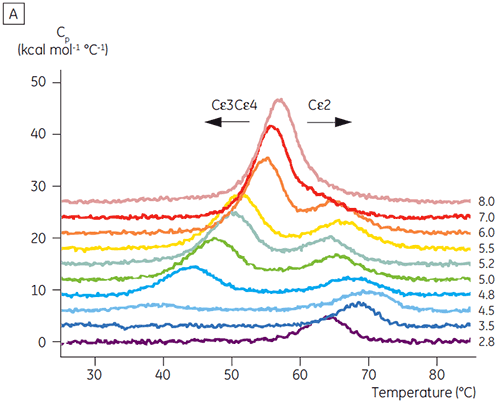
さまざまなpHにおけるFcεの熱変性を遠紫外線CDで測定しました。 pH 7.0では、3つ全てのドメイン(Cε2-4)のアンフォールディングで転移が1つ起こりました。 pH6.0では似たような転移が確認されましたが、みかけのTm値は1℃低下しました。 pH5.2におけるFcεの熱変性では、中性のpHのときよりも6℃低い温度から始まるブロードの転移が得られました。 pH4.8の条件でのみ、2つのはっきりとした転移がみられました。
これらのCD結果に基づき、pHに依存した安定性の詳細な研究がFcεとFcγの両方に対して行われました。 FcεとFcγのアンフォールディング転移は非可逆的で、スキャンレートに依存していました(データ未記載)。これは、非可逆的な凝集が両方のタンパク質のTm値に影響することを示唆しています(6,7)。 CDで測定した結果とは異なり、FcεはpH8以下の全てのpHで2つの独立したアンフォールディング転移があることが示されました(図2A)。 2つの転移のうちの1つは、低いpHで高いNaCl濃度のときに不安定化されましたが、もう一方は安定でした。
|
|
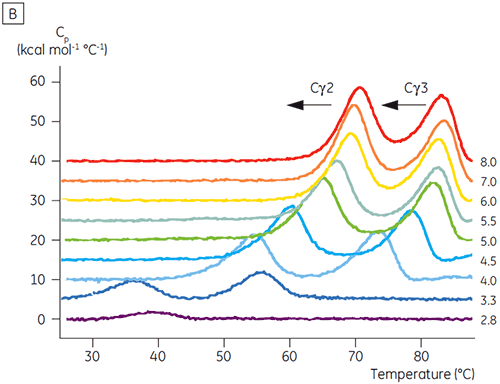
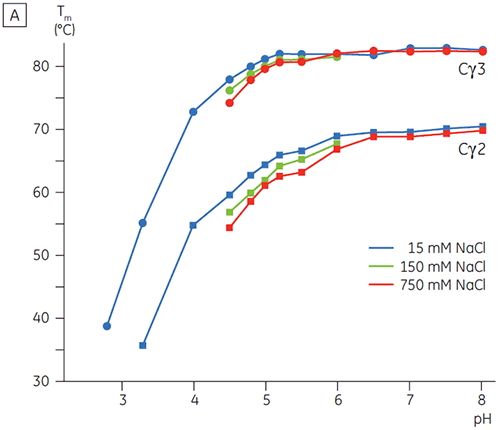
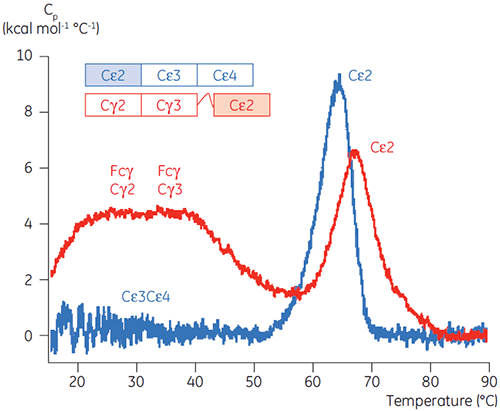
pHの影響を受ける転移に関わるドメインは、pH4.5で完全にアンフォールドされました。これは、CDで得えられた構造データに基づく予測と同様でした。また、このことはフォールド状態のドメインの安定性たけでなく、フォールディングの状態を理解する上でDSCのデータがいかに重要になりうるかを示しています。 IgG1のFcγは2つの別々の転移を経てアンフォールドすることが示されました。Cγ2ドメインは低温側の転移で、Cγ3 ドメインは高温側の転移でした(図2B)。 脱グルコシル化が熱安定性に与える影響からCγ2の転移が同定され(データ未発表)、Cγ3の転移は非常に高い熱安定性があることがわかりました。 どちらのFcγドメインも、pHとNaClに感受性があることが明らかになりました。 Fcεとは異なり、FcγドメインはpHが3.0以下になるまでアンフォールドされませんでした。これはなぜ3.5以下のpHで抗体をProtein Aから溶出するのか、またなぜ陽イオン交換クロマトグラフィーがIgGの精製に適しているのかの理由を示唆しています(図3)。
|
|
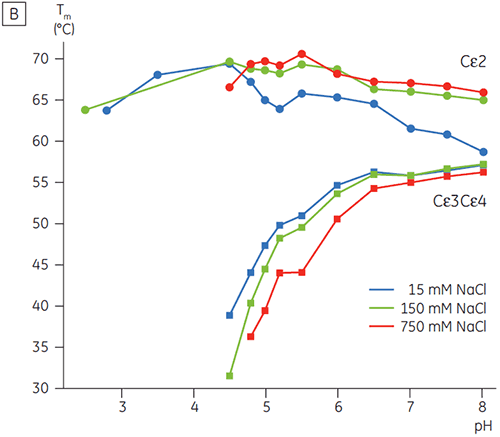
高塩濃度下で、FcγのCγ2とCγ3ドメインおよびFcεのCε3とCε4ドメインが不安定化しました。 これは中間のpH範囲(5.0~7.0)での15 mM NaClと比較して、150および750 mM NaClのTm値がわずかに変化するように見えました。(図3A) Cγ2およびCγ3ドメインのTmが60°C以上を維持しているため、この安定性の小さな差はこのpH範囲内でのin vitroのFcγの半減期に大きな影響を与えているとは考えにくいです。
Fcγ-Cε2融合タンパク質のDSC実験を実行することで、FcεのpH感受性ドメインが、ドメイン(Cε3とCε4)を結合する受容体として識別されました。 Fcγ-Ce2とFcεのドメインの1つはpH 2.5で安定にフォールドしています(図4)。 上記の実験に基づき、FcγドメインはpH 3.0以下で、もともとアンフォールドされることが知られています。 よって、FcεのCε2ドメインがpH非感受性ドメインと同定されます。 これらの結果はpH4.5における制限タンパク質分解によって裏づけられました(5)。
|
高塩濃度では、FcεのCε2ドメインはやや高い熱安定性を示していました。 Cε2は15 mM NaClで測定したTm値と比べ、特に中性付近のpHと750 mM NaClの条件で7℃以上安定化しました。 一方、NaClは、pH 5~6でCε3Cε4ドメインを大幅に不安定化させました(図3B)。 Cε3Cε4は、低塩濃度のpH 5.0でアンフォールドし始めました。 高塩濃度では、アンフォールディング転移は0.5 pH単位シフトし、pH 5.5になりました。このことは、IgEまたはFcεを含むたんぱく質の精製ステップで、カチオン交換クロマトグラフィーは有効でないことを意味します。
この研究では、Fcεがきわめて高いpH感受性を示し、その結果、Fcγよりも2 pH高いpH 5.0で、受容体結合ドメインのアンフォールディングが起こることを明らかにしました。 DSCによって確認されたFcεのpH/塩感受性は、IgEベースのタンパク質の精製方法、取扱手順、製剤を選定する上で有用な情報を提供し、標準的なIgGプロトコールの適用が難しいことを示唆しています。 また、FcγのpH安定性データは、低pH溶出に加え、保持させる標準的なアフィニティ精製(例:通常はProtein A樹脂)の際の、 時間に依存したIgG凝集のメカニズムを示唆しています。
このアプリケーションノートは、Biogen Idec(カリフォルニア州サンディエゴ)のDr Stephen Demarestの厚意により提供していただきました。
1. Zhu, D. et al. A novel human immunoglobulin Fcγ Fcε bifunctional fusion protein inhibits Fcε RI-mediated degranulation. Nature Med. 8, 518–521 (2002).
2. Zhu, D. et al. A chimeric human-cat fusion protein blocks cat-induced allergy. Nature Med. 11, 446-449 (2005).