
分析装置の適格性確認
検証済み(GxP)環境での機器の適格性確認とアプリケーションのための包括的なソリューション

OmnilTrustのパンフレットをダウンロード-これは、規制環境向けのコンプライアンスソリューションです. Download now
Download now検証済み(GxP)環境での機器の適格性確認とアプリケーションのための包括的なソリューション


製薬業界では、規制コンプライアンスが非常に重要です。製薬会社は、安全で効果的な製品を消費者に届けるために、厳格な規制に従う必要があります。

主な規制とガイドライン
これらの規制に従うことは、時間と労力がかかり、ストレスを感じることがあります。しかし、これにより製品の品質と安全性が保証され、消費者の信頼を得ることができます。
製造管理および品質管理に関する基準(GMP/ICH Q7)要件を含む、適正製造基準(GxP)が、この枠組みを形成しています。 装置は、設置適格性確認および稼働性能適格性確認(IQ/OQ)の手順およびドキュメントを使用して、お客様のユーザー仕様要求(URS)に適合している必要があります。 その後、継続的パフォーマンス認定(PQ)スケジュールの一環として規制試験を実施する必要があります。
検証/規制された環境で測定を実行するには、これまで以上に注意が必要です。 21 CFR Part 11への準拠に加えて、データの長期保存/アクセシビリティ、分析装置自体の適格性確認など、測定値(Alcoa++)のデータ整合性を考慮する必要があります。 場合によっては、測定の検査と承認にかかる時間がサンプル処理時間を超えることがあります。 これは、安全な医薬品の開発・製造に必要な枠組みの一部です。 OmniTrustパッケージを含む当社のソフトウェアは、(適切なローカルITインフラストラクチャを使用して) 21 CFR Part 11準拠およびAlcoa++データ整合性ガイダンスを可能にします。 このコンプライアンスは、関連する規制機関からの定期的なサーベイランス審査によってテストされます。
規制環境で使用される機器の認定およびソフトウェア開発に長年の経験があることから、この分野では幅広い知識を持っています。 当社製品に包括的なIQ/OQなどの必需品を提供するとともに、次のような取り組みを行っています。
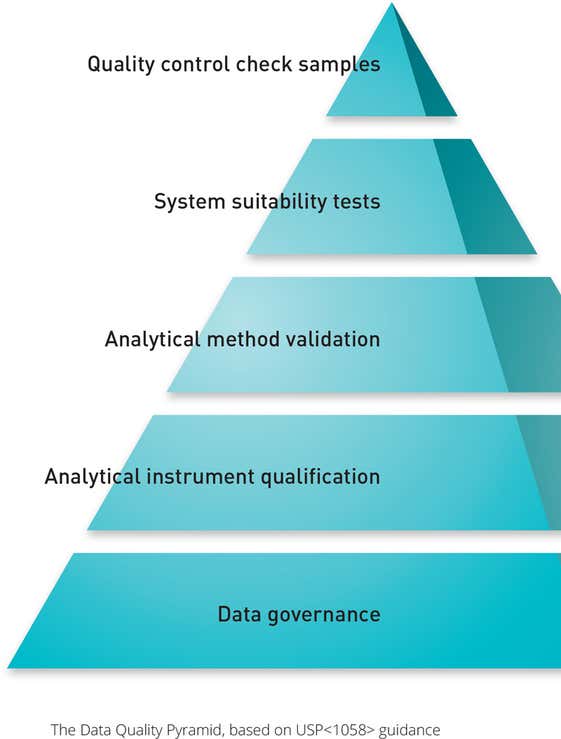
USP <1058>に詳述されている要件では、検証プロセスにおけるIQ/OQの重要性を浮き彫りにしました。 これらの手順は、機器の元のユーザー仕様要求(URS)と、そのパフォーマンス認定(PQ)およびパフォーマンス検証(PV)に直接リンクされています。
稼働性能適格性確認では、機器がエンドユーザーのアプリケーションに適合しているかどうかをテストするとともに、製造業者が設計したとおりに動作するかどうかをテストする必要もあります。
Malvern PANalyticalでは、この目的のために包括的なIQ/OQパッケージを提供しています。また、追加のテストニーズについてもお気軽にお問い合わせください。
測定の監査には時間がかかることがあるため、当社のソフトウェアには、このプロセスをお客様にとってより効率的にするための、多くの機能が含まれています。 シンプルで強力な設計で、実装と日常的な使用にかかる時間を短縮し、ワークフローを合理化し、審査中に予期せぬ事態が発生しないという完全な確信を得られるようになっています。 これは、21 CFR Part 11準拠ソリューションの一部です(堅牢なITポリシーと組み合わせて使用)。
主なソフトウェア機能は次のとおりです。
 OmniTrustのパンフレットをダウンロード:Malvern PANalyticalの規制環境向けコンプライアンスソリューション
OmniTrustのパンフレットをダウンロード:Malvern PANalyticalの規制環境向けコンプライアンスソリューション
当社は、お客様のすべての検証ニーズに対応するさまざまなリファレンスおよびキャリブレーション標準試料を提供しています。
当社のカスタマーサポートチームは、IQ/OQサービスを実行し、検証テストスクリプトを提供して、21 CFR Part 11およびソフトウェアのデータ整合性機能を検証できます。
追加の検証要件に関するお問合せはお気軽にどうぞ。
当社は、OmniTrustパッケージを含むソフトウェアを規制環境で使用するために提供しています。このパッケージは、監査証跡、電子署名、階層型アクセスなどの機能を有効にすることでメリットがあります。

